题目内容
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:
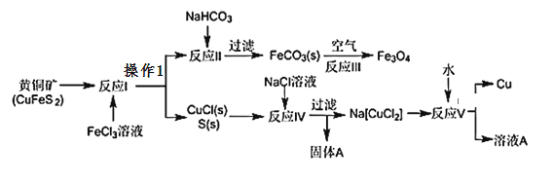
(1)黄铜矿中Cu的化合价是______,反应I中________molFeC13 可氧化0.1mol CuFeS2。
(2)实验室在进行操作1时,除使用烧杯外,还需使用的玻璃仪器有___________。
(3)工业生产中的过滤操作多采用倾析法(倾析法:先把清液倾入漏斗中,让沉淀尽可能地留在烧杯内)分离出固体物质,下列适合用倾析法的有____________。
a.沉淀的颗粒较大 b.沉淀呈胶状 c.沉淀容易沉降 d.沉淀呈絮状。
(4)固体物质A的成分________(写名称),本流程中可实现循环使用的物质除水外还有_______________
(5)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________________________________。
【答案】+20.4漏斗、玻璃棒ac硫氯化钠(NaCl)6FeCO3+O2![]() 2Fe3O4+6CO2
2Fe3O4+6CO2
【解析】
(1)黄铜矿CuFeS2中铁元素显+2价,S元素显-2价,故铜元素显+2;CuFeS2中硫元素化合价由-2价升高到0价,共升高4价,硫元素被氧化,氧化0.1mol CuFeS2转移0.4mol电子;三价铁还原为二价铁化合价降1,若得电子0.4mol,则应消耗FeC130.4mol; (2)实验室在进行操作1后得到固体和溶液则为过滤,除使用烧杯外,还需使用的玻璃仪器有漏斗、玻璃棒;(2)沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离,沉淀呈胶状或絮状,静止后不容易沉降,不能采取倾析法分离;答案选项ac;(4)滤渣为S、CuCl,与NaCl溶液发生反应Ⅳ:CuCl+NaCl=Na[CuCl2],S不溶,过滤得到Na[CuCl2]溶液,固体为S;反应Ⅳ使用氯化钠溶液,反应Ⅴ生成的溶液A含有CuCl2、NaCl,氯化钠可循环使用;(5)高温氧化锻烧法来制备磁性氧化铁,化学方程式为:6FeCO3+O2![]() 2Fe3O4+6CO2。
2Fe3O4+6CO2。

 作业辅导系列答案
作业辅导系列答案【题目】下列反应中生成H2的速率最快的是( )
金属 | 酸溶液 | 温度 | |
A | Mg | 0.5 mol·L-1 H2SO4 | 20℃ |
B | Mg | 1 mol·L-1 H2SO4 | 30℃ |
C | Zn | 2 mol·L-1 HCl | 20℃ |
D | Fe | 1 mol·L-1 HCl | 20℃ |
A.AB.BC.CD.D
【题目】下表列出的有关表述中不准确的是
序号 | A | B | C | D |
物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
代表物质 | NaCl | 金刚石 | 干冰 | Ne |
组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
A.AB.BC.CD.D