题目内容
16.(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是CaCl2、KOH、Na2O2、Na2S,只含共价键的是CO2、H2SO4,既含有离子键又含有共价键的是KOH、Na2O2.(2)书写下列物质的电子式,NH4Cl
 ,CO2
,CO2 .
.
分析 (1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;
(2)氯化铵为离子化合物,复杂阳离子和阴离子均需要括号;二氧化碳为共价化合物.
解答 解:(1)CaCl2只含有离子键;KOH既有离子键又有共价键;CO2只含有共价键;H2SO4只含有共价键;Na2O2既有离子键又有共价键;Na2S只含有离子键,
故答案为:CaCl2、KOH、Na2O2、Na2S;CO2、H2SO4;KOH、Na2O2;
(1)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
,二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,故答案为:
,故答案为: ;
; .
.
点评 本题考查了离子键和共价键的判断和电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
7.短周期元素X、Y、Z、W在周期表中的位置关系如表所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
 (1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
(1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为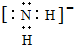 .
.
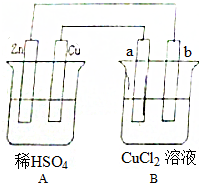
(2)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式CO-2e-+O2-═CO2.
(3)关于该电池的下列说法,正确的是AC.
A.工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高.
| X | Y | Z | |
| W |
 (1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
(1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为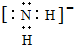 .
.(2)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式CO-2e-+O2-═CO2.
(3)关于该电池的下列说法,正确的是AC.
A.工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高.
4.下列说法不正确的是( )
| A. | 不能自发进行的氧化还原反应,也可以通过电解来实现 | |
| B. | 电解质溶液导电是化学变化,金属导电是物理变化 | |
| C. | 电解池和原电池中均发生氧化还原反应 | |
| D. | 电解、电离、原电池均需要通电 |
11.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④离子半径:r(Na)<r(Cl)<r(S).
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④离子半径:r(Na)<r(Cl)<r(S).
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
1.1molCH2═CH-CH═CH-CH3与溴水发生加成反应最多需要多少溴水( )
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
8.化学已经渗透到人类生活的各个方面,下列说法正确的是( )
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 服用铬含量超标的药用胶囊会对人体健康不会造成危害 | |
| D. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 |

 .
.