题目内容
6.(1)写出下列物质的电子式:HClO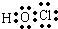
(2)用电子式表示下列物质的形成过程:MgCl2
 .
.
分析 (1)HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;
(2)镁原子最外层有两个电子易失去最外层的2个电子形成稳定的镁离子,卤原子最外层有7个电子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁.
解答 解:(1)HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: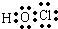 ,故答案为:
,故答案为: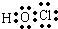 ;
;
(2)镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示下列物质的形成过程为 ,
,
故答案为: .
.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法.

练习册系列答案
相关题目
17.下列关于如图所示装置的叙述,正确的是( )
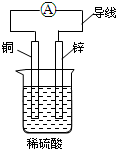

| A. | 锌片为负极,铜片为正极 | |
| B. | 该装置能将电能转化为化学能 | |
| C. | 铜片发生的反应为Cu-2e-═Cu2+ | |
| D. | 电流方向是由锌片通过导线流向铜片 |
1.下列物质中,不能与小苏打反应的是( )?
| A. | 甲酸 | B. | 乙酸 | C. | 硫酸 | D. | 乙醇 |
11.下列说法不正确的是( )
| A. | 某微粒空间构型为三角锥形,则该微粒一定是极性分子 | |
| B. | 某微粒空间构型为V形,则中心原子一定有孤电子对 | |
| C. | NH4+中N-H键能、键长和键角均相同 | |
| D. | SiF4和SO${\;}_{3}^{2-}$的中心原子均为sp3杂化,其立体构型都是正四面体 |
15.在以下的分子或离子中,空间结构的几何形状不是三角锥形的是( )
| A. | NF3 | B. | CH${\;}_{3}^{-}$ | C. | SO3 | D. | H3O+ |
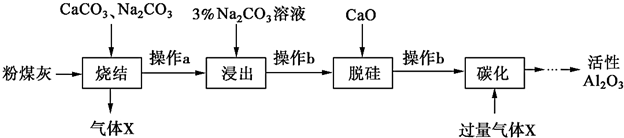
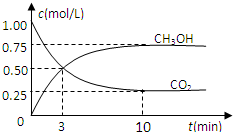 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示. ,CO2
,CO2 .
.