题目内容
13.等体积pH=1的两种酸溶液A和B,分别加水稀释1000倍后,其pH分别为5和3,下列判断一定正确的是( )| A. | 加入Mg粉,生成H2的体积:V(A)<V(B) | |
| B. | A为弱酸,B为强酸 | |
| C. | 加入Mg粉,生成H2的平均反应速率v(A)<v(B) | |
| D. | A溶液比B溶液导电性强 |
分析 pH=1的A、B分别加水稀释1000倍后,其pH分别为5和3,说明A为强电解质、B为弱电解质,
A.没有告诉相同条件下,无法比较二者产生氢气的体积大小;
B.根据分析可知,A为强酸、B为弱酸;
C.由于B为弱酸,则反应过程中氢离子浓度逐渐减小,B的电离程度增大,据此判断A、B与镁生成氢气的反应速率大小;
D.溶液导电性与溶液中离子浓度大小有关,两溶液中pH相同,则导电性相同.
解答 解:pH=1的A、B分别加水稀释1000倍后,其pH分别为5和3,说明A为强电解质、B为弱电解质,
A.必须在相同条件下才能比较生成氢气体积大小,故A错误;
B.结合分析可知,A为强酸、B为弱酸,故B错误;
C.反应过程中溶液中氢离子浓度减小,B为弱电解质,则B的电离程度增大,开始反应后B中氢离子浓度始终大于A,则反应速率v(A)<v(B),故C正确;
D.A、B两溶液的pH相等,则氢离子浓度相等,溶液导电性与离子浓度及所带电荷有关,则两溶液导电性相同,故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,根据稀释过程中溶液pH变化正确判断两溶液的酸性强弱为解答关键,注意掌握弱电解质的电离平衡及其影响因素;D为易错点,需要明确溶液影响溶液导电性的因素.

练习册系列答案
相关题目
16.下面是用电子式表示某些物质的形成过程,其中正确的是( )
| A. | H•+ →H+[ →H+[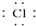 ]- ]- | B. | K•+ →K →K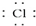 | C. | 2H•+ →H →H H H | D. | 2Na•+ →Na →Na Na Na |
17.白藜芦醇的结构简式为: ,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )
,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )
 ,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )
,它广泛存在于食物(例如桑葚、花生尤其是葡萄)中,具有抗癌性.能够跟1mol该化合物起反应昀Br2或H2的最大用量分别是( )| A. | 1mol,1mol | B. | 3.5mol,7mol | C. | 3.5mol,6mol | D. | 6mol,7mol |
1.在常温下,把一个盛有等物质的量的甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体充分反应,下列叙述中不正确的是( )
| A. | 容器内原子总数不变 | |
| B. | 足够长时间后容器内氯化氢分子数最少 | |
| C. | 容器内气体颜色变浅 | |
| D. | 容器内分子总数不变 |
8.下列说法中正确的是( )
| A. | 淀粉水解与纤维素水解时所生成的最终产物相同 | |
| B. | 蔗糖是最重要的二糖,它的相对分子质量是葡萄糖的二倍 | |
| C. | 油脂、淀粉、纤维素都是天然高分子化合物 | |
| D. | 油脂可以与NaOH溶液发生皂化反应 |
18.有机物中碳原子和氢原子个数比为3:4,不能与溴水反应却能使KMnO4酸性溶液褪色.其蒸气密度是相同状况下甲烷密度的7.5倍.在溴化铁存在时与溴反应,能生成两种一溴代物.该有机物可能是( )
| A. | CH≡C-CH3 | B. | 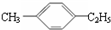 | C. | CH2=CHCH3 | D. | 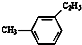 |
5.下列反应中,属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | CH2=CH2+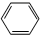 $\stackrel{一定条件}{→}$ $\stackrel{一定条件}{→}$ | |
| C. | CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$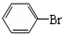 +HBr +HBr |
2.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- | |
| B. | 加入金属铝产生H2的溶液中:NH4+、K+、SO42-、NO3- | |
| C. | 含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO32- |
3.戊烷(C5H12) 共有a种同分异构体,甲苯( )共有b种一氯代物,则a、b的数值分别为( )
)共有b种一氯代物,则a、b的数值分别为( )
 )共有b种一氯代物,则a、b的数值分别为( )
)共有b种一氯代物,则a、b的数值分别为( )| A. | 2、3 | B. | 3、4 | C. | 4、4 | D. | 3、5 |