题目内容
1.在常温下,把一个盛有等物质的量的甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体充分反应,下列叙述中不正确的是( )| A. | 容器内原子总数不变 | |
| B. | 足够长时间后容器内氯化氢分子数最少 | |
| C. | 容器内气体颜色变浅 | |
| D. | 容器内分子总数不变 |
分析 A.化学变化前后原子的种类不变即元素种类不变,原子个数也没有增减;
B.甲烷在发生取代反应时,除了生成有机物之外,还有氯化氢生成,且有几个氢原子,就生成几分子氯化氢,所以氯化氢的量最多;
C.氯气为黄绿色气体,随着反应进行,氯气浓度变小;
D.有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应属于取代反应,取代反应中分子数不变.
解答 解:A.原子是化学变化中的最小微粒,根据质量守恒定律,化学变化前后原子的种类不变,故A正确;
B.甲烷在发生取代反应时,除了生成有机物之外,还有氯化氢生成,且有几个氢原子,就生成几分子氯化氢,所以氯化氢的量最多,故B错误;
C.氯气为黄绿色气体,随着反应进行,氯气浓度变小,颜色变浅,故C正确;
D.取代反应分子总数不变,如甲烷的第一步取代:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,两分子反应生成两分子,故D正确;
故选B.
点评 本题考查质量守恒定律、化学反应中压强的变化,取代反应的判断等,题目难度不大,掌握甲烷的取代反应是解题的关键.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
4.今年是世界反法西斯战争暨中国人民抗日战争胜利70周年.二战期间日本是在战场上唯一大量使用毒气弹的国家.芥子气〔(ClCH2CH2)2S〕是其中一种毒气,即使嗅觉不能感受的极低浓度也会对人造成伤害,可用NaOH溶液解毒.芥子气可用以下方法制备:2CH2=CH2+S2Cl2→(ClCH2CH2)2S+S.下列有关说法正确的是
( )
( )
| A. | 芥子气不是烃的衍生物 | B. | S2Cl2中有极性键和非极性键 | ||
| C. | 制备反应中S2Cl2作还原剂 | D. | NaOH溶液解毒原理是中和反应 |
5.下列各组微粒中,属于同素异形体的是( )
| A. | O2、O3 | B. | H、D、T | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | Na2O、Na2O2 |
2.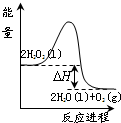 过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
 过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )
过氧化氢一定条件下可发生分解:2H2O2(l)═2H2O(l)+O2(g),其能量变化如图所示,下列说法正确的是( )| A. | 该分解反应为吸热反应 | |
| B. | 2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量 | |
| C. | 加入MnO2或FeCl3均可提高该分解反应的速率 | |
| D. | 其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢 |
9.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 室温下,28g乙烯和丙烯的混合物中含有的碳原子数为NA | |
| B. | 常温下,pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体中含有的原子数目为NA | |
| D. | 1L 1mol•L-1的NaClO 溶液中含有ClO-的数目为NA |
6.分子式为C5H10O2的羧酸共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 种 |
13.等体积pH=1的两种酸溶液A和B,分别加水稀释1000倍后,其pH分别为5和3,下列判断一定正确的是( )
| A. | 加入Mg粉,生成H2的体积:V(A)<V(B) | |
| B. | A为弱酸,B为强酸 | |
| C. | 加入Mg粉,生成H2的平均反应速率v(A)<v(B) | |
| D. | A溶液比B溶液导电性强 |
10.25°C和101kpa时,甲烷、乙烯和乙炔组成的混合烃30mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了55mL,原混合烃中乙炔的体积分数为( )
| A. | 25% | B. | 33.3% | C. | 66.7% | D. | 75% |
