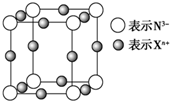
题目内容
2.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 0.1 mol•L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- | |
| B. | 加入金属铝产生H2的溶液中:NH4+、K+、SO42-、NO3- | |
| C. | 含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO32- |
分析 A.偏铝酸钠与铝离子发生双水解反应生成氢氧化铝沉淀;
B.加入铝产生氢气的溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应,硝酸根离子在酸性条件下具有强氧化性,加入铝不会生成氢气;
C.四种离子之间不反应,都不与次氯酸根离子反应;
D.pH=1的溶液中存在大量氢离子,铁离子、酸性条件下的硝酸根离子能够氧化亚硫酸根离子,亚硫酸根离子能够与氢离子反应.
解答 解:A.NaAlO2、Al3+之间发生双水解反应生成氢氧化铝沉淀,在溶液中不能大量共存,故A错误;
B.加入金属铝产生H2的溶液为酸性或强碱性溶液,NH4+与氢氧根离子反应,NO3-在酸性条件下与铝反应生成的不是氢气,故B错误;
C.K+、Na+、NO3-、SO42-之间不发生反应,都不与ClO-反应,在溶液中能够大量共存,故C正确;
D.室温下,pH=1的溶液中存在大量氢离子,Fe3+、酸性条件下的NO3-都能够与SO32-之间发生氧化还原反应,SO32-与氢离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
5.下列各组微粒中,属于同素异形体的是( )
| A. | O2、O3 | B. | H、D、T | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | Na2O、Na2O2 |
13.等体积pH=1的两种酸溶液A和B,分别加水稀释1000倍后,其pH分别为5和3,下列判断一定正确的是( )
| A. | 加入Mg粉,生成H2的体积:V(A)<V(B) | |
| B. | A为弱酸,B为强酸 | |
| C. | 加入Mg粉,生成H2的平均反应速率v(A)<v(B) | |
| D. | A溶液比B溶液导电性强 |
10.25°C和101kpa时,甲烷、乙烯和乙炔组成的混合烃30mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了55mL,原混合烃中乙炔的体积分数为( )
| A. | 25% | B. | 33.3% | C. | 66.7% | D. | 75% |
17.下列涉及有机物的性质的说法错误的是( )
| A. | 苯不能使KMnO4溶液褪色,而甲苯使KMnO4溶液褪色 | |
| B. | 聚氯乙烯简称PVC,能够使溴的四氯化碳溶液褪色 | |
| C. | 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
12.下列说法正确的是( )
| A. | 煤的干馏、石油的分馏都只发生了物理变化 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成了CO2和H2O | |
| C. | 甲烷和苯都能发生取代反应 | |
| D. | 乙醇和乙酸互为同分异构体 |
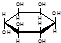 与葡萄糖
与葡萄糖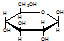 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物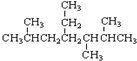 的名称为2,5,6-三甲基-4-乙基庚烷.
的名称为2,5,6-三甲基-4-乙基庚烷.