题目内容
已知某溶液中存在较多的 ,该溶液中还可能大量存在的离子组是
,该溶液中还可能大量存在的离子组是
A.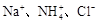 | B.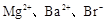 |
| C.Mg2+、Cl-、Fe2+ | D.K+、SiO 、Cl- 、Cl- |
A
解析试题分析:A.H+、SO42-、NO3-可以与选项中的离子大量共存,不会发生任何反应。正确。B发生反应:Ba2++ SO42-==BaSO4↓,不能大量共存,错误。C.发生反应:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑。不能大量共存,错误。D.发生反应:SiO32-+2H+=H2SiO3↓,不能大量共存,错误。
考点:考查离子共存的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验过程中产生的现象与所给图形相符合的是( )
| A.往乙酸中通入氨气 |
B.往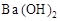 溶液中滴加硫酸 溶液中滴加硫酸 |
| C.往氢硫酸溶液中通入氯气 |
| D.往NaOH溶液中通入过量CO2 |
下列反应一定有沉淀生成的是
| A.将SO2通入BaCl2溶液中 | B.将NH3通入AgNO3溶液中 |
| C.将Cl2通入AgNO3溶液中 | D.将NO2通入Ca(OH)2溶液中 |
下列各组离子在溶液中为无色,且能大量共存的是( )
| A.Cu2+、SO42-、Na+、Cl- | B.Na+、CO32-、H+、K+ |
| C.Mg2+、H+、SO42-、NO3- | D.Ag+、NO3-、K+、Cl- |
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素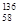 Ce、 Ce、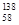 Ce、 Ce、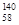 Ce、 Ce、 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.由于氧化性:Ce4+>Fe3+,而I-有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑.错误。 |
下列电离或离子方程式正确的是
A.亚硫酸的电离:H2SO3 2H++ SO3 2H++ SO3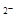 |
B.氯化铵水解的离子方程式为:NH4+ +H2O  NH3·H2O + H+ NH3·H2O + H+ |
C.NaHCO3水解的离子方程式为:HCO3-+H2O CO3 CO3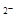 +H3O+ +H3O+ |
D.向氯化铝溶液中加入过量的氨水:A1 +3NH3·H2O= Al(OH)3↓+3NH4+ +3NH3·H2O= Al(OH)3↓+3NH4+ |
下列离子方程式书写正确的是
A.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2 I2+2H2O I2+2H2O |
B.Cu片插入FeCl3溶液中:Cu+Fe3+ Fe2++Cu2+ Fe2++Cu2+ |
C.向Al2(SO4)3溶液中加入过量的氨水: Al3++4NH3·H2O  AlO2-+4NH4++2H2O AlO2-+4NH4++2H2O |
| D.向 NaHSO4溶液中滴加Ba(OH)2溶液至中性: |
 BaSO4↓+H2O
BaSO4↓+H2O 下列关于电解质溶液的正确判断是
| A.在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以常量共存 |
| B.在pH=0的溶液中,Na+、NO3-、SO32-、K+可以常量共存 |
| C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- |
D.由0.1 mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O HA+OH- HA+OH- |
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是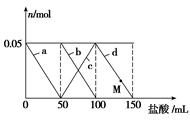
| A.a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
| B.b和c曲线表示的离子反应是相同的 |
| C.M点时,溶液中沉淀的质量为3.9 g |
| D.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2 |