题目内容
下列电离或离子方程式正确的是
A.亚硫酸的电离:H2SO3 2H++ SO3 2H++ SO3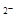 |
B.氯化铵水解的离子方程式为:NH4+ +H2O  NH3·H2O + H+ NH3·H2O + H+ |
C.NaHCO3水解的离子方程式为:HCO3-+H2O CO3 CO3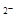 +H3O+ +H3O+ |
D.向氯化铝溶液中加入过量的氨水:A1 +3NH3·H2O= Al(OH)3↓+3NH4+ +3NH3·H2O= Al(OH)3↓+3NH4+ |
BD
解析试题分析:A、亚硫酸是弱电解质,是分步电离的,往往以第一步为主,错误;B、正确;C、不是水解的方程式,应该为:HCO3-+H2O  H2CO3+OH-,错误;D、正确。
H2CO3+OH-,错误;D、正确。
考点:考查电离与水解的有关知识。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
| 阳离子 | NH4+、 Na+、 Mg2+ |
| 阴离子 | OH-、 NO3-、 SO42- |
若取等质量的甲、乙、丙配制成相同体积的溶液,发现溶质的物质的量浓度c(甲)>c(乙)>c(丙),则乙物质
A.可能是NaOH B.可能是NH4NO3
C.不可能有SO42- D.一定不是(NH4)2SO4
下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH-=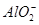 +H2↑ +H2↑ |
B.硫酸镁溶液跟氢氧化钡溶液反应: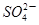 +Ba2+=BaSO4↓ +Ba2+=BaSO4↓ |
| C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
D.铜片跟稀硝酸反应:Cu+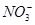 +4H+=Cu2++NO↑+2H2O +4H+=Cu2++NO↑+2H2O |
下列各组离子能在指定溶液中大量共存的是( )
①无色溶液中:Al3+,Cl-,Na+,HCO3-,SO42-
②使pH=11的溶液中:Na+,AlO2-,NO3-,S2-,SO32-
③加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
④使pH试纸呈红色的溶液中:Fe3+,MnO4-,Na+,SO42-
⑤酸性溶液中:Fe2+,Al3+,NO3-,I-
| A.①②④ | B.①⑤ | C.②③④ | D.①②③ |
已知某溶液中存在较多的 ,该溶液中还可能大量存在的离子组是
,该溶液中还可能大量存在的离子组是
A.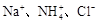 | B.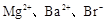 |
| C.Mg2+、Cl-、Fe2+ | D.K+、SiO 、Cl- 、Cl- |
下列离子方程式或化学方程式不正确的是
| A.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2―=Ag2S↓+2C1― |
| B.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na2O2 +2CO2=2Na2CO3+O2 |
| C.向酸性KMnO4溶液中加入H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
| D.在0.1mol/L CH3COONa溶液中:c(Na+)=c(CH3COOH)+c(CH3COO―) |
下列各组离子一定能大量共存的是
| A.在强碱性溶液中: NH4+、Na+、NO3-、CO32- |
| B.能使紫色石蕊试液变蓝的溶液中:Ca2+、Fe2+、AlO2-、Cl- |
| C.某无色溶液中:Cu2+、Al3+、NO3-、SO42- |
| D.含有大量H+的溶液中:Na+、K+、Al3+、NO3- |
下列离子方程式中正确的是
| A.Fe(OH)3滴加稀盐酸:OH- + H+=H2O |
| B.向石灰乳[Ca(OH)2]溶液通入过量的二氧化碳:Ca2++2OH- +CO2=CaCO3↓+H2O |
| C.MgCl2溶液中滴加氨水:Mg2+ + 2OH-=Mg(OH)2↓ |
| D.NaHSO4溶液中加BaCl2溶液:SO42- + Ba2+= BaSO4↓ |
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是 ( )
| A.Na+ | B.SO42- | C.Ba2+ | D.NH4+ |