题目内容
下列各组离子在溶液中为无色,且能大量共存的是( )
| A.Cu2+、SO42-、Na+、Cl- | B.Na+、CO32-、H+、K+ |
| C.Mg2+、H+、SO42-、NO3- | D.Ag+、NO3-、K+、Cl- |
C
解析试题分析:A选项,铜离子蓝色。B选项,碳酸根不能与氢离子大量共存。C选项正确。D选项,银离子与氯离子不能大量共存。
考点:离子共存

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
已知氧化性:Br2>Fe3+>I2,向含有a mol FeI2的溶液中加入含b mol Br2的溴水,下列判断或相应的离子方程式正确的是
| A.当a=2,b=1时,离子方程式为:2Fe2++Br2→2Fe3++2Br- |
| B.如果反应后的溶液中存在c(Fe2+)=c(Fe3+),则4/5<a/b<1 |
| C.当a=1,b=2时,离子方程式为:2Fe2++4I-+3Br2→2Fe3++2I2+6Br- |
| D.当a=2,2<b<3时,溶液中铁元素以两种离子形式存在,且一定是c(Fe3+)>c(Fe2+) |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol/L的盐酸,测得溶液中CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )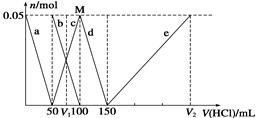
| A.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2 |
| B.V1∶V2=l∶5 |
| C.M点时生成的CO2为0.05 mol |
| D.a曲线表示的离子方程式为AlO2-+H++H2O=Al(OH)3↓ |
下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH-=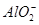 +H2↑ +H2↑ |
B.硫酸镁溶液跟氢氧化钡溶液反应: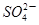 +Ba2+=BaSO4↓ +Ba2+=BaSO4↓ |
| C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
D.铜片跟稀硝酸反应:Cu+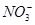 +4H+=Cu2++NO↑+2H2O +4H+=Cu2++NO↑+2H2O |
某溶液中有银离子、镁离子、亚铁离子和铝离子,若向其中通入过量的氨气,水浴加热后并搅拌后过滤出沉淀,再向沉淀中加入足量的盐酸,则所得新溶液中数目大量减少且在上述条件下能形成沉淀的阳离子是( )
| A.银离子 | B.亚铁离子 | C.镁离子 | D.铝离子 |
下列各组离子能在指定溶液中大量共存的是( )
①无色溶液中:Al3+,Cl-,Na+,HCO3-,SO42-
②使pH=11的溶液中:Na+,AlO2-,NO3-,S2-,SO32-
③加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
④使pH试纸呈红色的溶液中:Fe3+,MnO4-,Na+,SO42-
⑤酸性溶液中:Fe2+,Al3+,NO3-,I-
| A.①②④ | B.①⑤ | C.②③④ | D.①②③ |
已知某溶液中存在较多的 ,该溶液中还可能大量存在的离子组是
,该溶液中还可能大量存在的离子组是
A.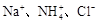 | B.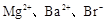 |
| C.Mg2+、Cl-、Fe2+ | D.K+、SiO 、Cl- 、Cl- |
下列各组离子一定能大量共存的是
| A.在强碱性溶液中: NH4+、Na+、NO3-、CO32- |
| B.能使紫色石蕊试液变蓝的溶液中:Ca2+、Fe2+、AlO2-、Cl- |
| C.某无色溶液中:Cu2+、Al3+、NO3-、SO42- |
| D.含有大量H+的溶液中:Na+、K+、Al3+、NO3- |
下列解释实验事实的离子方程式不正确的是( )
| A.用烧碱溶液吸收NO2:2NO2+2OH-=NO3-+ NO2-+ H2O |
| B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
| C.明矾溶液与过量氨水反应:Al3+ +3NH3.H2O=Al(OH)3↓ + 3NH4+ |
| D.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |