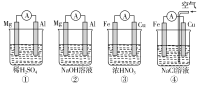
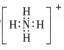题目内容
【题目】随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示。
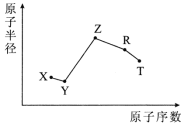
已知:TX2是现代光学及光纤制品的基本原料;
ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是___。
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的结构式为___。
(3)请用一个化学方程式比较X和Y的非金属性的强弱_____。
(4)工业上以Z3RY6作助熔剂的目的是____。
【答案】第3周期IIIA族 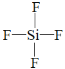 (或其他正确答案即可) 2F2+2H2O = 4HF+O2 降低氧化铝的熔融温度,节约冶炼铝的能源
(或其他正确答案即可) 2F2+2H2O = 4HF+O2 降低氧化铝的熔融温度,节约冶炼铝的能源
【解析】
TX2是现代光学及光纤制品的基本原料,则为SiO2,T为Si,X为O,根据半径大小得出Y为F,化合物ZY能破坏水的电离平衡,则Z为Na,Z3RY6在工业上常用作助熔剂,则为Na3AlF6,故R为Al。
⑴R为Al,核外电子排布为2、8、3,在元素周期表中的位置是第3周期IIIA族;故答案为:第3周期IIIA族。
⑵上述元素中的某两种元素可组成一种五原子共价化合物,该化合物是SiF4,该化合物的结构式为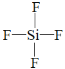 ;故答案为:
;故答案为: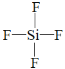 (或其他正确答案即可)。
(或其他正确答案即可)。
⑶比较F和O的非金属性,可利用氟气与水发生反应,置换出氧气的规律来证明,化学方程式为2F2+2H2O = 4HF+O2;
故答案是:2F2+2H2O = 4HF+O2;
⑷氧化铝熔点高,熔融时耗能大,因此工业上以Z3RY6作助熔剂的目的是降低氧化铝的熔融温度,节约冶炼铝的能源;
故答案为:降低氧化铝的熔融温度,节约冶炼铝的能源。

【题目】下列有关实验操作、现象和结论都正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
D | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. AB. BC. CD. D