题目内容
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30 mL 1.0 mol·L1 H3PO4和 3 mL 30% H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30 mL 1.0 mol·L1H3PO4和3 mL H2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85% H3PO4配制100 mL 1.0 mol·L1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)实验Ⅱ中铁钉表面产生气体的化学方程式是______。
(3)探究停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。
甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。
①实验Ⅳ证实了形成氧化膜过程中产生H+。
实验Ⅳ:______(填操作),滴入少量FeSO4溶液后,立即测定pH,pH迅速降低。
②形成氧化膜(以Fe2O3计)的离子方程式是______。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率
角度分析其原因:______。
【答案】100mL容量瓶 ![]() 未排除氧气的干扰 取与实验I初始时pH和浓度均相同的H2O2溶液于试管中
未排除氧气的干扰 取与实验I初始时pH和浓度均相同的H2O2溶液于试管中 ![]() 铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离:随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气
铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离:随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气
【解析】
题目是进行探究性实验,在实验I中,铁钉表面产生气泡,是因为铁与H3PO4反应生成氢气,因为溶液保持澄清,根据信息可知还生成了Fe(H2PO4)2,一段时间后再产生大量气泡,再停止,出现周而往复的现象,与实验II对比可知是H2O2发生了作用,再根据后续的探究性实验分析出现周而往复的现象的原因。
(1)根据配制一定物质的量的溶液所需要的仪器,还缺少100mL容量瓶,故答案为:100mL容量瓶;
(2)由题目信息可知,铁与H3PO4反应生成氢气和Fe(H2PO4)2,化学方程式为:![]() ;
;
(3)氧气在酸性条件下可以将亚铁离子氧化成成铁离子,故实验Ⅲ无法证实假设成立,故答案为:未排除氧气的干扰;
(4)①、实验Ⅳ要证实形成氧化膜过程中产生H+,根据控制变量的思想,操作为:取与实验I初始时pH和浓度均相同的H2O2溶液于试管中,滴入少量FeSO4溶液后,立即测定pH,pH迅速降低;故答案为:取与实验I初始时pH和浓度均相同的H2O2溶液于试管中;
②、亚铁离子被H2O2溶液氧化为Fe2O3,离子方程式为:![]() ;
;
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析如下:铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离:随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气。
故答案为:铁与磷酸反应生成氢气和Fe2+,Fe2+在铁钉表面迅速被氧化形成氧化膜,使聚集在铁钉表面的氢气脱离:随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气泡,当氧化膜溶解后,铁又与磷酸反应产生氢气。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
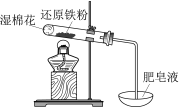
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D