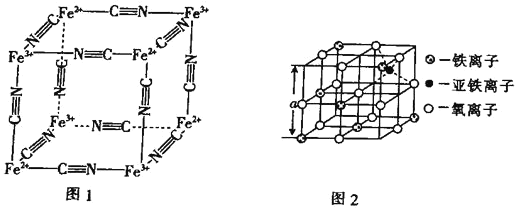
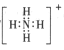题目内容
【题目】已知电解NaOH溶液即电解水:2H2O![]() 2H2↑+O2↑。现对100g 11.7%的NaCl溶液进行电解,总共通过电子0.4mol。
2H2↑+O2↑。现对100g 11.7%的NaCl溶液进行电解,总共通过电子0.4mol。
(1)在阴极产生的氢气的体积(按标准状况计)为______
(2)阳极产生的氧气的物质的量为__________
(3)假定控制条件使Cl2未从电解液中逸出,电解结束后经充分搅拌Cl2与NaOH发生了完全反应,生成NaClO和部分NaClO3。求完全反应后电解池中三种钠盐的总质量____
【答案】4.48L 0.05mol 13.3g
【解析】
电解NaCl溶液时,阳极上氯离子先放电生成氯气,当氯离子完全析出后,氢氧根离子放电生成氧气;阴极上氢离子放电生成氢气。
(1)100g11.7%的NaCl溶液中,![]() ,阴极上电极反应式为2H++2e-=H2,通过的电子为0.4mol,则生成氢气在标况下体积为
,阴极上电极反应式为2H++2e-=H2,通过的电子为0.4mol,则生成氢气在标况下体积为
![]() 。
。
(2)阳极上氯离子完全电解转移的电子为0.2mol,因此氢氧根离子电解时转移的电子为0.2mol,4OH--4e-=2H2O+O2,根据氧气和转移电子之间的关系得,生成得氧气的物质的量为![]() 。
。
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和NaClO3。根据氯元素守恒可知![]() 。原来的盐为氯化钠,现在的盐为氯化钠、次氯酸钠和NaClO3,可知完全反应后三种钠盐的质量等于原氯化钠的质量加上氧元素的质量。设反应后n(NaCl)=x,n(NaClO)=y,n(NaClO3)=z,根据氯原子守恒及得失电子守恒得:
。原来的盐为氯化钠,现在的盐为氯化钠、次氯酸钠和NaClO3,可知完全反应后三种钠盐的质量等于原氯化钠的质量加上氧元素的质量。设反应后n(NaCl)=x,n(NaClO)=y,n(NaClO3)=z,根据氯原子守恒及得失电子守恒得:![]() ,解得y+3z=0.1mol。完全反应后电解池中三种钠盐得总质量=原来氯化钠的质量+氧元素的质量为
,解得y+3z=0.1mol。完全反应后电解池中三种钠盐得总质量=原来氯化钠的质量+氧元素的质量为![]() 。
。

【题目】热化学:(1)已知:C(s)+H2O(l)=CO(g)+H2(g) ΔH1=a kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH2=bkJ·moL-1;
2H2(g)+O2(g)=2H2O(l) ΔH3=ckJ·moL-1;
则C(s)+O2(g)=CO2(g) ΔH=___(用a、b、c表示)kJ·moL-1。
(2)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热ΔH=___。
化学键 | C—H | C—F | H—F | F—F |
键能(kJ·mol-1) | 414 | 489 | 565 | 155 |
【题目】下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化为I2。它们的转化关系如下:(有些反应的条件和部分产物为注明)

(1)写出下列物质化学式:B_________,F_______________;
(2)写出反应①的化学方程式:____________________;
(3)H在空气中很容易被氧化为I,该过程的实验现象是__________________;
(4)将足量的CO2通入E溶液中,离子方程式是___________________。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有__________。
A.具有丁达尔现象 |
B.红褐色液体可用过滤的方法纯化 |
C.液体中分散质微粒直径小于1nm |
D.取适量液体加入K2SO4溶液会产生红褐色沉淀 |