题目内容
下列离子方程式不正确的是
A.用铜电极电解NaCl溶液:2 Cl-+2H2O  Cl2↑+H2↑+2 OH- Cl2↑+H2↑+2 OH- |
| B.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
| C.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
| D.Cl2通入FeBr2溶液中,Cl2与FeBr2物质的量之比4︰5:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl- |
A
解析试题分析:A、用铜电极电解NaCl溶液,阳极上Cu失电子生成Cu2+,错误;B、氢氧化铁溶于氢碘酸中,Fe3+具有氧化性。把I?氧化为I2,正确;C、Fe3+与col-发生相互促进的水解反应,生成Fe(OH)3沉淀和HClO,正确;D、Cl2与FeBr2物质的量之比4︰5,Cl2先氧化Fe2+,然后氧化部分Br?,离子方程式符合Cl2与FeBr2物质的量之比为4︰5,正确。
考点:本题考查离子方程式的书写。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某强碱性溶液中含有的离子是:K+、NH4+、A13+、AlO2-、CO32-、SiO32-、Cl-中的某几种,现进行如下实验:
①取少量的溶液用足量硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加人盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
③另取一定量的原溶液中加人5 mL0. 2 mol/L盐酸时,沉淀会完全消失,加人足量的硝酸银溶液可得到沉淀0.187 g。下列说法中正确的是 ( )
| A.该溶液中一定不含NH4+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有A13+、CO32-、Cl- |
| C.Cl-可能含有 |
| D.该溶液中一定含有AlO2-、CO32-、Cl- |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是
| A.Mg2+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
下列反应的离子方程式中,书写正确的是
A.氯气溶于水: |
B.将铝粉投入氢氧化钠溶液中: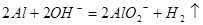 |
C.铜与氯化铁溶液反应: |
D.过氧化钠与水反应: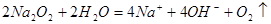 |
下列分子或离子在指定的分散系中能大量共存的一组是
| A.银氨溶液: Na+、K+、NO3-、NH3·H2O |
| B.空气: C2H2、CO2、SO2、NO |
| C.氢氧化铁胶体: H+、K+、S2-、Br- |
| D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子 |
下列表示对应化学反应的离子方程式正确的是
| A.用白醋除铁锈:Fe2O3+6H+=3H2O+2Fe3+ |
| B.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热: Ba2++ 2OH-+NH4++ HCO3-  NH3↑+2H2O+BaCO3↓ NH3↑+2H2O+BaCO3↓ |
| C.用过量冷氨水吸收SO2:SO2+NH3·H2O=HSO3-+NH4+ |
| D.用强碱吸收工业制取硝酸尾气:NO+ NO2+2OH-=2NO3-+H2O |
下列离子方程式书写正确的是( )
A.碳酸钠溶液滴入酚酞变红: CO32- + 2H2O  H2CO3 + 2OH- H2CO3 + 2OH- |
| B.铜溶解于氯化铁溶液中:2Fe3++3Cu=2Fe+3Cu2+ |
| C.氯化铝溶液与过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| D.FeSO4溶液中滴入稀硝酸:3Fe2+ + 4H+ + NO3- = 3Fe3+ + 2H2O + NO↑ |
在溶液中加入过量Na2O2后仍能大量共存的离子组是
| A.Fe2+、NH4+、Cl-、NO3- | B.K+、CO32-、Cl-、SO42- |
| C.Ca2+、Na+、NO3-、HCO3- | D.Na+、H+、Cl-、Br- |
下列反应的离子方程式书写正确的是
| A.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O |
| B.碳酸钙溶于醋酸:CaCO3 + 2H+ =Ca2+ + CO2↑+ H2O |
| C.向硅酸钠溶液中通入过量的CO2:SiO32-+ CO2 + H2O= H2SiO3↓+ CO32- |
| D.澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-="=" CaCO3↓+H2O |