题目内容
下列反应的离子方程式中,书写正确的是
A.氯气溶于水: |
B.将铝粉投入氢氧化钠溶液中: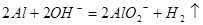 |
C.铜与氯化铁溶液反应: |
D.过氧化钠与水反应: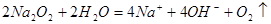 |
D
解析试题分析:A.HClO是弱酸,不能写成离子形式。正确的应该为:Cl2+H2O=H++Cl-+HClO。错误。B.反应原理错误。H2O还参加了化学反应。2Al+2 H2O+2OH-=2AlO2-+3H2↑.错误。D.反应符合客观事实,离子方程式拆写符合要求。正确。
考点:考查离子方程式的书写的知识。

练习册系列答案
相关题目
室温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中可能大量共存的是
| A.NH4+、Fe2+、NO3-、SO42- |
| B.Ba2+ 、Na+、Cl-、NO3- |
| C.Na+、Cl-、SO42-、HCO3- |
| D.HCO3-、Na+、AlO2-、Cl- |
下列各组离子中在水溶液中能大量共存的是( )
| A.Fe2+、K+、ClO—、Cl— | B.Ag+、Na+、Cl—、NO3- |
| C.NH4+、K+、CO32—、Br— | D.H+、Ca2+、CH3COO—、HCO3— |
下列离子方程式书写正确的是 ( )
| A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- =Al(OH)3↓ |
C.三氯化铁溶液中加入铁粉: |
| D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
下列离子方程式书写正确的是:
| A.氯化铝溶液和过量的氨水反应:Al3++4NH3·H2O=AlO2-+4NH4+ |
| B.少量的CO2通入NaOH溶液中:CO2+2OH-=CO32-+H2O |
| C.醋酸加入小苏打溶液中:HCO3-+H+=CO2↑+H2O |
D.硫化钠的水解:S2-+2H2O H2S+2OH- H2S+2OH- |
下列离子方程式不正确的是
A.用铜电极电解NaCl溶液:2 Cl-+2H2O  Cl2↑+H2↑+2 OH- Cl2↑+H2↑+2 OH- |
| B.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
| C.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
| D.Cl2通入FeBr2溶液中,Cl2与FeBr2物质的量之比4︰5:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl- |
下列离子方程式书写正确的是
| A.铁溶于盐酸中 2Fe + 6H+ = 2Fe3+ + 3H2↑ |
| B.碳酸钠与硫酸溶液反应 CO32ˉ + H+ = CO2↑+ H2O |
| C.二氧化硫被烧碱溶液吸收 SO2 +2OHˉ= SO32ˉ + H2O |
| D.铜与稀硝酸反应 Cu + 8H+ + 2NO3ˉ= Cu2+ + 2NO↑ + 4H2O |
下列各组离子中,一定能在指定溶液中大量共存的是:
| A.澄清透明的无色溶液:ClO-、CrO42-、Al3+、SO42- |
| B.能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- |
| C.常温呈中性的溶液中:Fe3+、K+、Cl-、SO42- |
| D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |