题目内容
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是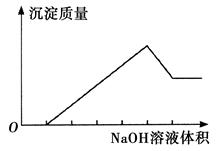
| A.Mg2+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
B
解析试题分析:在溶液中加入NaOH溶液,开始无沉淀,说明溶液中含有大量的H+离子,发生反应:H++OH-=H2O;后来,随着氢氧化钠溶液的加入,沉淀越来越多,当达到最大值后沉淀又有所减少,说明溶液中含有Al3+。产生的氢氧化铝有两性,沉淀能被过量的氢氧化钠溶解。溶液中还含有能与OH-产生沉淀的其它离子。分析选项可知:B符合要求。A. 溶液无色说明不含有Fe2+,因为Fe2+是浅绿色的。错误。C. Ba2+不能与OH-发生离子反应。错误。D.溶液中无H+,加入氢氧化钠溶液,马上就有沉淀产生。与题干已知条件不符合。错误。
考点:考查图像法在离子鉴定中的应用的知识。

练习册系列答案
相关题目
下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是
| A.HCl、CaCO3、SO2 | B.KNO3、CH3COOH、NH3 |
| C.HClO、H2S、C2H5OH | D.BaSO4、H3PO4、H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN?、SO42? |
| B.pH=0的溶液:Al3+、Ag (NH3)2+、Cl?、SO42? |
| C.c(H+)/c(OH?)=10?10的溶液:K+、Ba2+、NO3?、Cl? |
| D.c( ClO? )=1.0 mol·L?1的溶液:Na+、SO32?、S2?、SO42? |
下列各组离子中在水溶液中能大量共存的是( )
| A.Fe2+、K+、ClO—、Cl— | B.Ag+、Na+、Cl—、NO3- |
| C.NH4+、K+、CO32—、Br— | D.H+、Ca2+、CH3COO—、HCO3— |
下列离子方程式书写正确的是 ( )
| A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- =Al(OH)3↓ |
C.三氯化铁溶液中加入铁粉: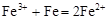 |
| D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
下列离子方程式不正确的是
A.用铜电极电解NaCl溶液:2 Cl-+2H2O  Cl2↑+H2↑+2 OH- Cl2↑+H2↑+2 OH- |
| B.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
| C.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
| D.Cl2通入FeBr2溶液中,Cl2与FeBr2物质的量之比4︰5:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl- |
 mol/L,一定会发生反应的离子组是
mol/L,一定会发生反应的离子组是