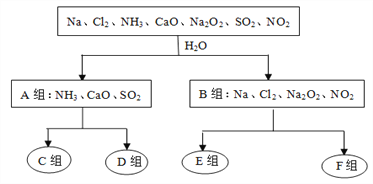
题目内容
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是

A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
【答案】C
【解析】根据题意可推出x、y、z、d、e、f、g、h分别为H、C、N、O、Na、Al、S、Cl。A.O2-、Na+和Al3+只有两个电子层,核外电子结构相同,核电荷数越大的离子半径越小,离子半径大小顺序为O2->Na+>Al3+,A错误;B. CH4、NH3、H2O中,CH4、NH3常温下为气体,H2O在常温下呈液态,沸点最高,B错误;C. 硫能够与热的强碱溶液反应生成硫化钠、亚硫酸钠等可溶性物质而除去,C正确;D. g、h的氧化物对应的水化物含氧酸有多种,不是最高价含氧酸,无法比较酸性强弱,D错误;答案选C。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________
该反应中氧化剂是_____;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________。
【题目】某兴趣小组同学在实验室用加热l﹣丁醇、浓H2SO4和溴化钠混合物的方法来制备1﹣溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出). 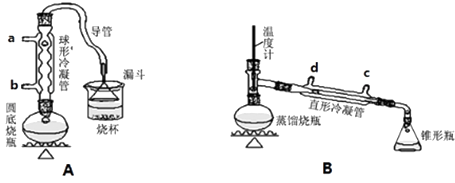
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是 . 两个装置中都用到了冷凝管,A装置中冷水从(填字母代号)进入,B装置中冷水从(填字母代号)进入.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是 . (填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“﹣CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?答: .
(4)为了进一步提纯1﹣溴丁烷,该小组同学查得相关有机物的有关数据如下表:
物质 | 熔点/℃ | 沸点/℃ |
1﹣丁醇 | ﹣89.5 | 117.3 |
1﹣溴丁烷 | ﹣112.4 | 101.6 |
丁醚 | ﹣95.3 | 142.4 |
1﹣丁烯 | ﹣185.3 | ﹣6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至收集所得馏分.