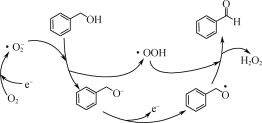
题目内容
【题目】某研究性学习小组利用下图装置研究硝酸的性质。
Ⅰ实验一:甲同学用图1装置来证实稀硝酸与铜反应生成NO。
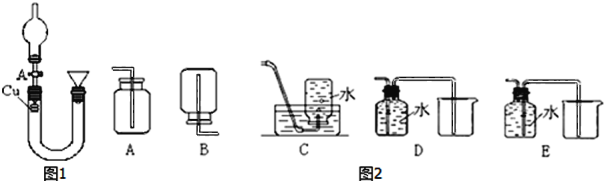
(1)请写出稀HNO3与Cu反应的离子方程式___。
(2)从A中向U形管中注满稀硝酸后,关闭A,待反应结束后,如何证明生成的无色气体气体是NO,操作是___。
(3)图2收集NO气体的各种装置中,合理的是___(填序号,多选不给分)。
(4)在100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol·L-1、0.2mol·L-1,向该混合液中加入2.56g铜粉,加热待充分反应后,所得溶液中Cu2+的物质的量浓度是___。
Ⅱ.实验二、乙组同学利用上述装置完成浓硝酸与铜的反应
(5)同学们发现实验室里有几瓶浓硝酸呈黄色,请用化学方程式和简单的文字说明解释这种现象___。
(6)同学们发现反应后的溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了NO2气体所致。同学们分别设计了以下4个实验来判断两种看法是否正确。
这些方案中可行的是___(填序号,多选不给分)
①加热该绿色溶液,观察颜色变化
②加水稀释绿色溶液,观察颜色变化
③向该绿色溶液中通入氮气,观察颜色变化
④向饱和硝酸铜溶液中通入NO2气体,观察颜色变化
【答案】3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 打开活塞A,使少量气体进入干燥管中,气体由无色变成红棕色,则证明有NO生成 CE c(Cu2+)=0.3mol/L 4HNO3(浓)![]() 4NO2↑+O2↑+2H2O,产生的NO2溶解在水中使溶液呈黄色 ①③④
4NO2↑+O2↑+2H2O,产生的NO2溶解在水中使溶液呈黄色 ①③④
【解析】
(1)稀硝酸与铜反应生成硝酸铜、一氧化氮、水;
(2)根据一氧化氮与氧气反应生成红棕色二氧化氮验证NO;
(3)根据NO的性质选择收集方法;
(4)根据3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O计算反应后Cu2+的物质的量浓度;
(5)浓硝酸易分解;
(6)要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置中溶液呈绿色,一是可设计将溶解的NO2赶走再观察颜色变化,二是改变溶液中Cu(NO3)2溶液的浓度观察反应后的颜色变化。
(1)稀硝酸与铜反应生成硝酸铜、一氧化氮、水,反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)一氧化氮与氧气反应生成红棕色二氧化氮,打开活塞A,使少量气体进入干燥管中,气体由无色变成红棕色,则证明有NO生成;
(3)NO与氧气反应生成NO2,NO难溶于水,所以收集NO只能用排水法,不选AB,D装置长进短出,不能收集NO,不选D,故选CE;
(4)2.56g铜粉的物质的量是0.04mol,在100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol·L-1、0.2mol·L-1,则H+的物质的量是0.08mol,NO3-的物质的量是0.04mol,根据3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,硝酸根离子过量,氢离子不足,0.08mol H+,溶解0.03molCu,生成 Cu2+的物质的量为0.03mol,c(Cu2+)=0.03mol÷0.1L =0.3mol/L;
(5). 浓硝酸易分解,4HNO3(浓)![]() 4NO2↑+O2↑+2H2O,产生的NO2溶解在水中使溶液呈黄色;
4NO2↑+O2↑+2H2O,产生的NO2溶解在水中使溶液呈黄色;
(6)①.加热该绿色溶液,二氧化氮气体挥发,通过颜色变化,可证明溶液颜色的变化原因,故选①;
②.加水稀释绿色溶液,Cu(NO3)2浓度降低同时二氧化氮和水反应,不能证明溶液颜色的变化原因,故不选②;
③.向该绿色溶液中通入氮气,可将二氧化氮气体排出,可证明溶液颜色的变化原因,故选③;
④.向饱和硝酸铜溶液中通入NO2气体,如颜色变为绿色,可证明溶液颜色的变化原因,故选④。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)该反应的热化学方程式为_______________________________________。
(2)又知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________。
Ⅱ.参考下列图表和有关要求回答问题。
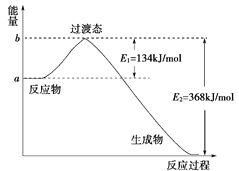
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________;
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
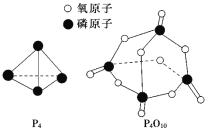
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。
【题目】下列有关实验操作、现象和结论都正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
D | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. AB. BC. CD. D