题目内容
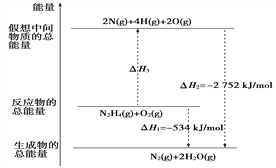
【题目】Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)该反应的热化学方程式为_______________________________________。
(2)又知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________。
Ⅱ.参考下列图表和有关要求回答问题。
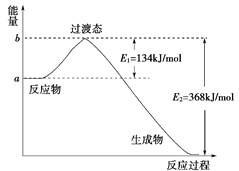
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________;
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
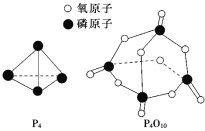
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。
【答案】N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640kJ/mol 408 产物是氮气和水,无污染 NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234 kJmol-1 ![]()
【解析】
Ⅰ.(1)0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256kJ的热量,则1mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出热量256kJ×![]() =640kJ,热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640 kJmol-1;
=640kJ,热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640 kJmol-1;
(2)①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640kJmol-1,②H2O(l)=H2O(g)△H=+44kJmol-1,根据盖斯定律①-②×4得到液态肼与液态双氧水反应生成液态水和氮气的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-816kJmol-1,所以16g液态肼即0.5molN2H4反应的反应热为816kJmol-1×0.5mol=408kJ;
(3)液态肼与足量液态双氧水反应,生成水蒸气和氮气,生成物对环境无污染;
Ⅱ.(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368 kJ-134 kJ=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1;
(2)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,则6mol×a kJ/mol+5 mol×c kJ/mol-12mol×bkJ/mol-4mol×xkJ/mol=-dkJ/mol,解得:x=![]() 。
。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10 mol/L Na2S2O3溶液与0.10 mol/L稀H2SO4反应速率的影响。反应方程式为:Na2S2O3+H2SO4 = Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 水/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | a | 10.0 | y |
③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为______,乙是实验需要测量的物理量,则表格中“乙”为________________________,x、y、z的大小关系是_______________________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g) +3H2(g) ![]() 2NH3(g)
2NH3(g)
①已知:
化学键 | H—H | N≡N | N—H | 键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是__________________________________________________。
②一定温度下,在一个容积固定的密闭容器中若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0. 3 mol/L、0.1 mol/L,达到平衡时NH3浓度c(NH3)的范围是________________________。
③ 下列说法中,能说明上述②中反应已经达到化学平衡状态的是_________________。
a. 1mol N≡N键断裂的同时,有6mol N-H键断裂 b. N2、NH3物质的量浓度不再改变 c. 容器中气体的密度保持不变 d. 容器内N2、 H2物质的量之比为1:3,且保持不变 e. 2 v正(NH3)=3 v逆 (H2)
④在工业生产中,及时分离出NH3,有利于合成氨,用平衡移动原理解释原因是_______________________。
【题目】活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和
活性炭(无杂质),生成气体E和F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
物质n/mol | 活性炭 | NO | E | F |
初始 | 2.030 | 0.100 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式:___________。
(2)上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。
①计算K1=_______________。
②根据上述信息判断,T1和T2的关系是_______(填序号)。
a.T1>T2b.T1<T2c.无法比较
(3)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是_______(填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F