题目内容
【题目】用软锰矿![]() 主要成分为
主要成分为![]() 生产高锰酸钾产生的锰泥中,还含有
生产高锰酸钾产生的锰泥中,还含有![]() 的
的![]() 、
、![]() 的
的![]() 均为质量分数
均为质量分数![]() ,及少量Cu、Pb的化合物等,用锰泥可回收制取
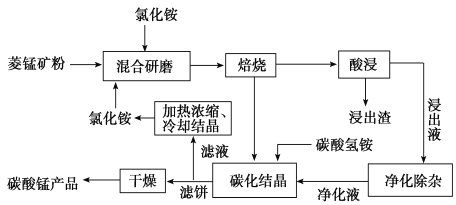
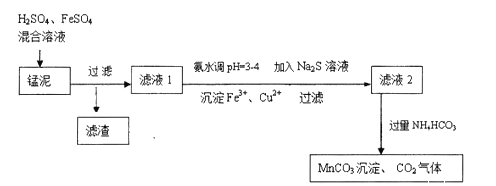
,及少量Cu、Pb的化合物等,用锰泥可回收制取![]() ,过程如图:
,过程如图:
![]() 高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
![]() 除去滤液1中
除去滤液1中![]() 的离子方程式是 ______ .
的离子方程式是 ______ .
![]() 经实验证明:
经实验证明:![]() 稍过量时,起始
稍过量时,起始![]() 、
、![]() 混合溶液中
混合溶液中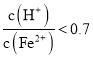 时,滤液1中能够检验出有
时,滤液1中能够检验出有![]() ;
;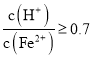 时,滤液1中不能检验出有
时,滤液1中不能检验出有![]() 根据上述信息回答①②③:
根据上述信息回答①②③:
①检验![]() 是否氧化完全的实验操作是 ______ .
是否氧化完全的实验操作是 ______ .
②生产时![]() 、
、![]() 混合溶液中
混合溶液中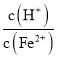 应控制在
应控制在![]() 之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
③若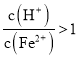 ,调节
,调节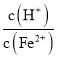 到
到![]() 的最理想试剂是 ______
的最理想试剂是 ______ ![]() 填序号
填序号![]()
![]() 溶液
溶液 ![]() 铁粉
铁粉 ![]()
![]() 写出滤液2中加入过量
写出滤液2中加入过量![]() 反应的离子方程式: ______ .
反应的离子方程式: ______ .
![]() 上述过程锰回收率可达
上述过程锰回收率可达![]() ,若处理1740kg的锰泥,可生产
,若处理1740kg的锰泥,可生产![]() ______ kg.
______ kg.
【答案】稀硫酸 ![]() 取少量滤液1于试管中,加入铁氰化钾溶液,若无蓝色沉淀生成,证明
取少量滤液1于试管中,加入铁氰化钾溶液,若无蓝色沉淀生成,证明![]() 被氧化完全
被氧化完全  过大,在调节pH环节会多消耗氨水 b
过大,在调节pH环节会多消耗氨水 b ![]()
![]()
【解析】
![]() 、
、![]() 混合溶液与锰泥中的二氧化锰发生氧化还原反应,将亚铁氧化为三价铁,然后过滤滤去硫酸铅和不溶的杂质,向滤液中加氨水来调节溶液的PH值以除去铁离子,并用硫化钠来沉淀铜离子,然后过滤滤去生成的沉淀,最后向滤液中加入过量的碳酸氢铵生成碳酸锰。
混合溶液与锰泥中的二氧化锰发生氧化还原反应,将亚铁氧化为三价铁,然后过滤滤去硫酸铅和不溶的杂质,向滤液中加氨水来调节溶液的PH值以除去铁离子,并用硫化钠来沉淀铜离子,然后过滤滤去生成的沉淀,最后向滤液中加入过量的碳酸氢铵生成碳酸锰。
![]() 高锰酸钾溶液具有强氧化性,盐酸易被氧化生成氯气,一般用稀硫酸酸化;
高锰酸钾溶液具有强氧化性,盐酸易被氧化生成氯气,一般用稀硫酸酸化;
![]() 除去滤液1中的
除去滤液1中的![]() 是硫离子和铜离子生成难溶于水的CuS;
是硫离子和铜离子生成难溶于水的CuS;
![]() 检验
检验![]() 的存在可以加入铁氰化钾溶液,观察是否生成蓝色沉淀;
的存在可以加入铁氰化钾溶液,观察是否生成蓝色沉淀;
![]() 生产时
生产时![]() 、
、![]() 混合溶液中
混合溶液中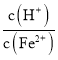 控制在
控制在![]() 之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;
之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;
![]() 若
若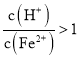 ,调节
,调节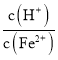 到
到![]() 的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生反应,生成氢气从而消耗氢离子,同时生成亚铁离子;
的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生反应,生成氢气从而消耗氢离子,同时生成亚铁离子;
![]() 滤液2中的锰离子与
滤液2中的锰离子与![]() 反应生成碳酸锰和二氧化碳与水;
反应生成碳酸锰和二氧化碳与水;
![]() 锰泥中含
锰泥中含![]() 的
的![]() ,锰回收率可达
,锰回收率可达![]() ,根据关系式
,根据关系式![]() ,进行计算。
,进行计算。
![]() 高锰酸钾溶液具有强氧化性,盐酸易被氧化生成氯气,一般用稀硫酸酸化,
高锰酸钾溶液具有强氧化性,盐酸易被氧化生成氯气,一般用稀硫酸酸化,
故答案为:稀硫酸;
![]() 除去滤液1中的
除去滤液1中的![]() 是硫离子和铜离子生成难溶于水的CuS,反应的离子方程式为:
是硫离子和铜离子生成难溶于水的CuS,反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 检验
检验![]() 的存在加入铁氰化钾溶液,观察溶液中是否产生蓝色沉淀,
的存在加入铁氰化钾溶液,观察溶液中是否产生蓝色沉淀,
故答案为:取少量滤液1于试管中,加入铁氰化钾溶液,若无蓝色沉淀生成,证明![]() 被氧化完全;
被氧化完全;
![]() 生产时
生产时![]() 、
、![]() 混合溶液中
混合溶液中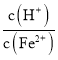 控制在
控制在![]() 之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费,
之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费,
故答案为: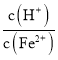 过大,在调节pH环节会多消耗氨水;
过大,在调节pH环节会多消耗氨水;
③若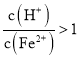 ,调节
,调节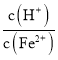 到
到![]() 的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生反应,生成氢气从而消耗氢离子,同时生成亚铁离子,所以最理想的试剂是铁粉,
的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生反应,生成氢气从而消耗氢离子,同时生成亚铁离子,所以最理想的试剂是铁粉,
故答案为:b;
![]() 滤液2中的锰离子与
滤液2中的锰离子与![]() 反应生成碳酸锰和二氧化碳与水,所以离子方程式为:
反应生成碳酸锰和二氧化碳与水,所以离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 锰泥中含
锰泥中含![]() 的
的![]() ,锰回收率可达
,锰回收率可达![]() ,根据关系式
,根据关系式 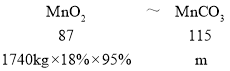 ,
,![]() ,解之得
,解之得![]() ,
,
故答案为:![]() .
.