题目内容
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图,判断下列叙述中正确的是
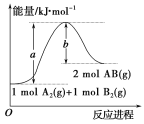
A.该反应的活化能是b kJ/mol
B.该反应热ΔH=+(a-b)kJ/mol
C.该反应中反应物的总能量高于生成物的总能量
D.1molA2(g)和1molB2(g)的能量总和是akJ
【答案】B
【解析】
从图中可以看出,a可以表示反应物的总键能或者正反应的活化能;同理,b可以表示生成物的总键能或逆反应的活化能。
A.该反应的活化能是akJ/mol,A不正确;
B.从图中可以看出,该反应的生成物的总能量大于反应物的总能量,为吸热反应,ΔH大于0;该反应热ΔH=反应物的总键能-生成物的总键能=+(a-b)kJ/mol,B正确;
C.该反应中反应物的总能量低于生成物的总能量,C不正确;
D.从图中无法确定反应物的能量总和,D不正确;
故选B。

 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】一定温度下,在三个容积均为2L的恒容密闭容器中按不同方式投入反应物,发生反应:2CO(g) + 4H2(g)CH3OCH3(g) + H2O(g) △H<0,测得反应的相关数据如下表:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 600 | 600 | 500 |
反应物投入量 | 0.2mol CO 0.4mol H2 | 0.4mol CO 0.8mol H2 | 0.2mol CH3OCH3 0.2mol H2O |
平衡v(CO)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡n(H2)/(mol) | 0.2 | n2 | n3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a1(CO) | a2(CO) | a3(CH3OCH3) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A.v1<v2,n2>0.4B.K2=2.5×103,p2>p3
C.2p1<p3,a1(CO) >a2(CO)D.n3<0.4,a2(CO) + a3(CH3OCH3)<1