题目内容
【题目】有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
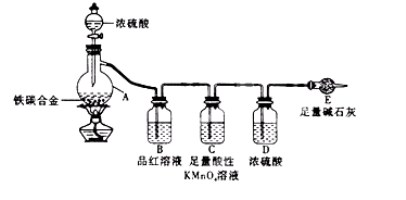
Ⅰ 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为________。
未点燃酒精灯前,A、B均无明显现象,其原因是: _。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式_______________________(任写一个)。B中的现象是______________,由此可得到浓硫酸具有____________性。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式____________(任写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是______________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是___________(填写代号)。
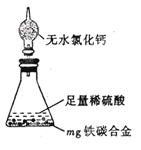
A. 用排水法测定H2的体积
B. 反应结束后,过滤、洗涤、干燥、称量残渣的质量
C. 测定反应前后装置和药品的总质量
【答案】(2)分液漏斗;常温下,Fe在浓硫酸中钝化,碳不与浓硫酸反应
(3)2Fe+6H2SO4(浓)=Fe2(SO4)3+3SO2↑+6H2O
或C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O;品红溶液逐渐褪色;强氧化
(4)2Fe3++Fe═3Fe2+或Fe+2H+═Fe2++H2↑
(5)铁、碳在酸溶液中形成原电池;
(6)![]()
(7)C
【解析】
试题分析:(2)根据图示,仪器A的名称为分液漏斗;常温下,铁在浓硫酸中钝化,碳不与浓硫酸反应,所以未点燃酒精灯前,A、B均无明显现象;(3)加热条件下,铁、碳都能与浓硫酸反应放出二氧化硫气体,方程式为2Fe+6H2SO4(浓)= Fe2(SO4)3+3SO2↑+6H2O或C+2H2SO4(浓)= CO2↑+2SO2↑+2H2O;二氧化硫能使品红褪色,B中的现象是品红溶液逐渐褪色;在反应中浓硫酸是氧化剂,由此可得到浓硫酸具有强氧化性;(4)随着反应的进行,浓硫酸成为稀硫酸,A中还可能发生铁与稀硫酸生成氢气,或铁与硫酸铁的反应,相应的离子方程式为2Fe3++Fe═3Fe2+ 或 Fe+2H+═Fe2++H2↑;(5)铁、碳在酸溶液中能形成原电池,所以反应一段时间后,从A中逸出气体的速率仍然较快;(6)E装置增加的质量就是CO2的质量,所以根据碳原子守恒可知,碳的质量是![]() g,铁碳合金中铁的质量分数为
g,铁碳合金中铁的质量分数为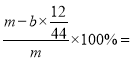
![]() ;(7)由于气体的体积测量往往受温度和压强的影响,不易测量,A不正确,B过程太复杂。C在反应中碳和稀硫酸不反应,只有铁和稀硫酸反应生成氢气和硫酸亚铁,所以可以根据质量守恒定律,常用实验C。
;(7)由于气体的体积测量往往受温度和压强的影响,不易测量,A不正确,B过程太复杂。C在反应中碳和稀硫酸不反应,只有铁和稀硫酸反应生成氢气和硫酸亚铁,所以可以根据质量守恒定律,常用实验C。

【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | H2O/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 molL﹣1mim﹣1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数不变
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
