题目内容
2.氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它.CuH不稳定,易分解;CuH在氯气中能燃烧;CuH跟盐酸反应能产生气体.以下有关推断中不正确的是( )| A. | “另一种反应物”在反应中表现还原性 | |
| B. | CuH在化学反应中既可做氧化剂也可做还原剂 | |
| C. | CuH在氯气中燃烧的化学方程式为CuH+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl+HCl | |
| D. | CuH与盐酸反应生成的气体是H2 |
分析 A.Cu元素的化合价由+2价降低为+1价,在反应中CuSO4作氧化剂;
B.CuH中Cu元素为+1价,既能升高又能降低;
C.CuH在氯气中能燃烧,Cu元素的化合价升高,Cl元素的化合价降低;
D.CuH跟盐酸反应能产生气体,气体为氢气.
解答 解:A.Cu元素的化合价由+2价降低为+1价,在反应中CuSO4作氧化剂,则“另一种反应物”在反应中作还原剂,具有还原性,故A正确;
B.CuH中Cu元素为+1价,既能升高又能降低,所以CuH既可做氧化剂也可做还原剂,故B正确;
C.CuH在氯气中能燃烧,Cu元素的化合价升高,Cl元素的化合价降低,则发生2CuH+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl↑,故C错误;
D.CuH跟盐酸反应能产生气体,气体为氢气,该反应中只有H元素的化合价发生变化,反应为CuH+HCl═CuCl+H2↑,故D正确;
故选C.
点评 本题考查氧化还原反应,注意利用信息及反应中元素的化合价变化来解答,题目难度不大,注重知识的迁移应用来考查学生.

练习册系列答案
相关题目
13.下列对碱金属性质的叙述中正确的是( )
| A. | 都是银白色的柔软金属(除铯外),密度都小于水 | |
| B. | 单质的熔、沸点随原子序数的增加而升高 | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 氧化能力最强的是铯原子 |
10.温度不变恒容的容器中0.1mol•L-1H2进行反应H2?2H,若某段时间内H2浓度由0.06mol•L-1降到0.036mol•L-1所需的反应时间为12s,则反应起始时H2浓度由0.1mol•L-1降到0.06mol•L-1需的时间为( )
| A. | 等于24s | B. | 等于20s | C. | 大于20s | D. | 小于20s |
17.把VL含有MgSO4和K2SO4的混合溶液分成两份,一份加入a mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁.则原混合溶液中钾离子的浓度为( )mol/L.
| A. | 2b-$\frac{a}{v}$ | B. | 2a-$\frac{b}{v}$ | C. | $\frac{2(2b-a)}{v}$ | D. | $\frac{2(2a-b)}{v}$ |
7. 如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )
如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )
 如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )
如图,A池用石墨电极电解饱和KCl溶液,B池精炼粗铜,当d极产生具有氧化性的气体在标准状况下为2.24L时停止通电,此时A池中KCl有剩余且溶液的体积为200mL,下列说法正确的是( )| A. | 向A池中通入4.48 L HCl气体可恢复到电解前的状态 | |
| B. | 停止通电后恢复至室温A池中溶液的pH值为14 | |
| C. | 电极e应为粗铜板材料且质量减少6.4 g | |
| D. | 该电路中通过的电子的物质的量为0.4 mol |
11.下列物质中,沸点最高的是( )
| A. | 一氯甲烷 | B. | 丁烷 | C. | 丙三醇 | D. | CH3 CH2O CH3 |
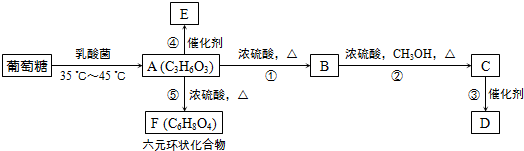
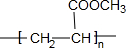 ,⑤2
,⑤2 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.
 物质间的三角转化关系是化学中常见关系,如图所示,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化.
物质间的三角转化关系是化学中常见关系,如图所示,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化. ,B的俗名是小苏打.
,B的俗名是小苏打.