题目内容
【题目】下列不能说明氯元素的非金属性比硫元素强的是( )
①![]() 比
比![]() 稳定
稳定
②![]() 氧化性比
氧化性比![]() 强
强
③![]() 酸性比
酸性比![]() 强
强
④![]() 能与
能与![]() 反应生成S
反应生成S
⑤![]() 与
与![]() 反应生成
反应生成![]() ,S与
,S与![]() 反应生成
反应生成![]()
A.①⑤B.②C.①④D.①③⑤
【答案】B
【解析】
①元素的非金属性越强,对应的氢化物越稳定。因为HCl比 H2S稳定,所以Cl比S非金属性强,故①正确;
②根据最高价氧化物的水化物的含氧酸的酸性强弱来比较非金属性的强弱,最高价含氧酸的酸性越强,则元素的非金属性越强,HClO不是最高价含氧酸,故②错误;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,因为HClO4酸性比![]() 强,所以Cl比S非金属性强,故③正确;
强,所以Cl比S非金属性强,故③正确;
④元素的非金属性越强,对应的单质的氧化性越强,因为Cl2能与H2S反应生成S,所以Cl比S非金属性强, 故④正确;
⑤元素的非金属性越强,对应的单质的氧化性越强,与变价金属反应的氧化化合价越高,Cl2与 Fe反应生成FeCl3,S与Fe反应生成FeS,说明Cl2 的氧化性大于S,所以非金属性Cl大于S,故⑤正确;
故选 B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
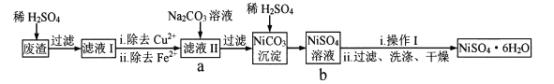
小学生10分钟应用题系列答案【题目】某工厂对工业污泥中的铬元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7 | — | — | — |
沉淀完全时的pH | 3.2 | 9 | 11.1 | 8 | 9(>9溶解) |
(1)实验室用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是__________。(用离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是________。
(5)钠离子交换树脂的原理为Mn++nNaR![]() MRn+nNa+,被交换的杂质离子是________。
MRn+nNa+,被交换的杂质离子是________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____Na2Cr2O7+____SO2+___ ___=___Cr(OH)(H2O)5SO4+___Na2SO4。____