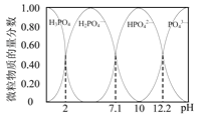
题目内容
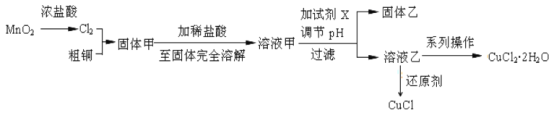
【题目】某工厂对工业污泥中的铬元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
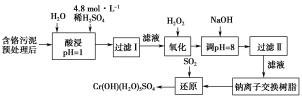
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7 | — | — | — |
沉淀完全时的pH | 3.2 | 9 | 11.1 | 8 | 9(>9溶解) |
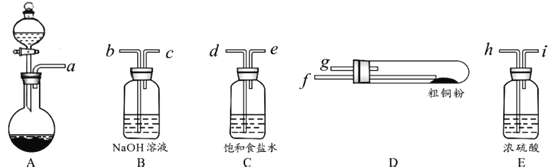
(1)实验室用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是__________。(用离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是________。
(5)钠离子交换树脂的原理为Mn++nNaR![]() MRn+nNa+,被交换的杂质离子是________。
MRn+nNa+,被交换的杂质离子是________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____Na2Cr2O7+____SO2+___ ___=___Cr(OH)(H2O)5SO4+___Na2SO4。____
【答案】65.2 250 mL容量瓶、胶头滴管 沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2~3次 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3+、Al3+ Ca2+、Mg2+ Na2Cr2O7+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4
【解析】
含铬污泥预处理后,用硫酸浸取液中金属离子主要是Cr3+,其次是 Fe2+、Fe3+、A13+、Ca2+、Mg2+,过滤除去不溶性杂质,然后加入过氧化氢氧化铬离子、亚铁离子为高价态,加入氢氧化钠溶液调节溶液pH=8使其他离子沉淀,过滤得到滤液用钠离子交换树脂交换镁离子,得到溶液中通入二氧化硫还原得到Cr(OH)(H2O)5SO4。
(1)浓硫酸物质的量浓度为![]() =
=![]() =18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,实验室中没有200 mL的容量瓶,应该选用250mL容量瓶配制,则需要浓硫酸体积为
=18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,实验室中没有200 mL的容量瓶,应该选用250mL容量瓶配制,则需要浓硫酸体积为![]() =0.0652L=65.2mL,需用到的玻璃仪器有:胶头滴管、玻璃棒、烧杯和100mL量筒、250mL容量瓶,所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需250mL容量瓶,胶头滴管,故答案为:65.2;250mL容量瓶,胶头滴管;
=0.0652L=65.2mL,需用到的玻璃仪器有:胶头滴管、玻璃棒、烧杯和100mL量筒、250mL容量瓶,所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需250mL容量瓶,胶头滴管,故答案为:65.2;250mL容量瓶,胶头滴管;
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是:沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次,故答案为:沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次;
(3)双氧水有强氧化性,能氧化还原性的物质,加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面Fe2+有还原性,Fe2+能被双氧水氧化为高价离子,Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)依据表格数据中离子开始沉淀和完全沉淀的pH,调节pH至8,可使Al3+、Fe3+生成沉淀,故答案为:Al3+、Fe3+;
(5)因镁离子、钙离子沉淀的pH较大,可用离子交换法除去,故答案为:Ca2+、Mg2+;
(6)通SO2气体时,还原过程中铬元素化合价+6价变化为+3价,Na2Cr2O~2CrOH(H2O)5SO4~6e-,硫元素化合价变化为+6价,SO2~SO42-~2e-,根据得失电子守恒,得到电子转移总数6e-,结合原子守恒配平得到化学方程式:Na2Cr2O7+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4,故答案为:Na2Cr2O7+3SO2+11H2O=2CrOH(H2O)5SO4↓+Na2SO4。

【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
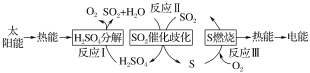
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH=-297kJ·mol-1
反应Ⅱ的热化学方程式:__。
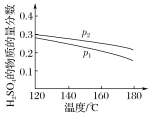
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2__p1(填“>”或“<”),得出该结论的理由是__。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+__=__+__+2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4mol·L-1KI | amol·L-1KI 0.2mol·L-1H2SO4 | 0.2mol·L-1H2SO4 | 0.2mol·L-1KI 0.0002molI2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__。
②比较A、B、C,可得出的结论是__。
③实验表明,SO2的歧化反应速率D>A。结合i、ii反应速率解释原因:___。