题目内容
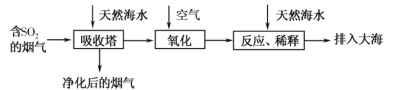
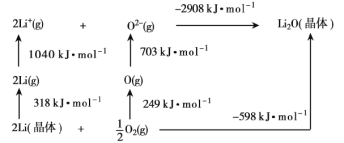
【题目】已知:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH=Q kJ·mol-1,其平衡常数随温度变化如表所示:
温度/k | 323 | 343 | 400 |
平衡常数 | 0.01 | 0.02 | 1 |
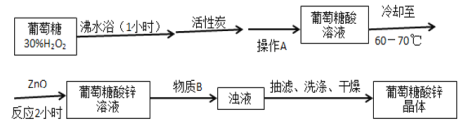
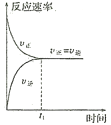
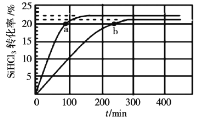
在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
请回答下列问题:
(1)该反应的Q___0(填“>”或“<”)。
(2)代表323K曲线的是___(填a或b)
(3)在400K下,要缩短反应达到平衡的时间,可采取的措施有___、___。
(4)已知2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___。
=___。
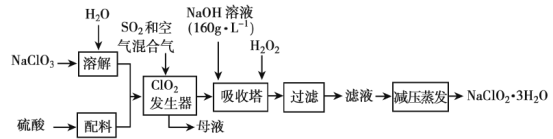
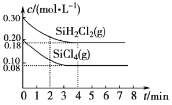
(5)TK时在体积为10L的反应器中,通入一定量的SiH2Cl2(g)和SiCl4(g),发生上述反应,SiH2Cl2(g)和SiCl4(g)浓度变化如图所示,则0~4 min时平均反应速率v(SiCl4(g))=___。
【答案】> b 改进催化剂 提高反应物浓度(或压强) 1.28 0.03mol·L-1·min-1
【解析】
(3)要缩短反应达到平衡的时间,需要提高反应速率,而影响反应速率的因素主要有温度、浓度、压强及催化剂等;
(4)反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,由平衡时正逆反应速率相等,可得出![]() =K(平衡常数),再结合此温度下的平衡状态,计算出平衡常数K即可计算a处
=K(平衡常数),再结合此温度下的平衡状态,计算出平衡常数K即可计算a处![]() ;
;
(5)根据图象中SiCl4(g)的浓度变化及v=![]() 计算0~4min时平均反应速率v(SiCl4(g))。
计算0~4min时平均反应速率v(SiCl4(g))。
(1)由图表可知,随着温度的升高,平衡常数增大,说明升高温度,平衡正向移动,即正反应为吸热反应,该反应的Q>0;
(2)温度越高,反应速率越快,达到平衡所需要的时间越短,则a曲线代表343K曲线,b曲线代表 323K曲线;
(3)在400K下,要缩短反应达到的时间,应增大反应速率,则在温度不变的条件下可采取的措施是:增大压强、使用催化剂或增大反应物的浓度等;
(4)由图象可知,a点时转化率为20%,设起始时SiHCl3的物质的量为nmol,此时
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)
起始物质的量(mol) n 0 0
变化物质的量(mol) 0.2n 0.1n 0.1n
终态物质的量(mol) 0.8n 0.1n 0.1n
则:xSiHCl3=![]() =0.8,x SiH2Cl2=x SiCl4=0.1;
=0.8,x SiH2Cl2=x SiCl4=0.1;
反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,则a点时v正=k正x2SiHCl3=0.82k正,v逆=k逆xSiH2Cl2xSiCl4=0.1×0.1k逆=0.01 k逆,由平衡时正逆反应速率相等,可得出![]() =K(平衡常数),则a处
=K(平衡常数),则a处![]() =
=![]() =
=![]() =
=![]() 0.02=1.28;
0.02=1.28;
(5)由图示可知SiCl4(g)在0~4 min时变化的物质的量浓度为0.20mol·L-1-0.08mol·L-1=0.12mol·L-1,则平均反应速率v(SiCl4(g))=![]() =0.03mol·L-1·min-1。
=0.03mol·L-1·min-1。