题目内容
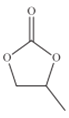
【题目】通过膜电池可除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,下列说法错误的是
),其原理如图所示,下列说法错误的是
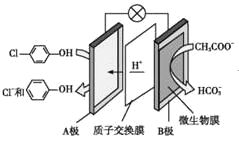
A.该方法能够提供电能
B.B极上的电势比A极上的电势低
C.A极的电极反应为![]() +H++2e-→Cl-+
+H++2e-→Cl-+![]()
D.电池工作时H+通过质子交换膜由正极区向负极区移动
【答案】D
【解析】
该装置为原电池,原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为![]() +H++2e-→Cl-+
+H++2e-→Cl-+![]() ,电流从正极经导线流向负极,据此解答。
,电流从正极经导线流向负极,据此解答。
A. 该装置为原电池,将化学能转化为电能,则该方法能够提供电能,A项正确;
B. 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A极为正极,B极为负极,则B极上的电势比A极上的电势低,B项正确;
C. A极为正极,有氢离子参与反应,电极反应式为![]() +H++2e-→Cl-+
+H++2e-→Cl-+![]() ,C项正确;
,C项正确;
D. 原电池中阳离子移向正极,则该原电池中氢离子向正极移动,D项错误;
答案选D。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】已知:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH=Q kJ·mol-1,其平衡常数随温度变化如表所示:
温度/k | 323 | 343 | 400 |
平衡常数 | 0.01 | 0.02 | 1 |
在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
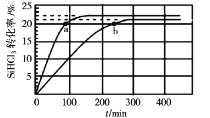
请回答下列问题:
(1)该反应的Q___0(填“>”或“<”)。
(2)代表323K曲线的是___(填a或b)
(3)在400K下,要缩短反应达到平衡的时间,可采取的措施有___、___。
(4)已知2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___。
=___。
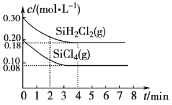
(5)TK时在体积为10L的反应器中,通入一定量的SiH2Cl2(g)和SiCl4(g),发生上述反应,SiH2Cl2(g)和SiCl4(g)浓度变化如图所示,则0~4 min时平均反应速率v(SiCl4(g))=___。
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11