题目内容
【题目】海水的综合利用一直是研究课题。某地天然海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子),研究用海水吸收燃煤排放的含有SO2烟气的工艺流程如图所示,下列说法中正确的是
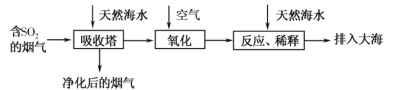
A.工艺中天然海水显酸性
B.氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C.排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D.若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
【答案】B
【解析】
A.天然海水中有CO32-或HCO3-,它们水解使海水呈弱碱性,故A错误;
B.氧化过程中可能发生的离子反应为:2SO2+2H2O+O2=4H++2SO42-,故B正确;
C.排入大海的溶液与天然海水相比,除了SO42-数量发生了变化,碳酸根离子和碳酸氢根离子数量也发生变化,故C错误;
D.海水中氯化钠含量最高,若将氧化后的液体进行蒸发结晶,得到的晶体中氯化钠含量最高,故D错误;
故答案为B。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案【题目】工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)已知CO(g)、H2(g)的标准燃烧热分别为 △H=-283kJmol-1, △H=-286kJmol-1,且CH3OH(g)+3/2O2(g) ![]() CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)
CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)![]() CH3OH(g)的△H= ___________。
CH3OH(g)的△H= ___________。
(2)为了提高CO和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是___________________________________________。(写出两点)
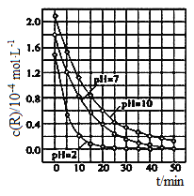
(3)实验室模拟用CO和H2反应来制甲醇,在250 ℃下,将一定量的CO和H2投入10 L的密闭容器中,各物质的物质的量浓度(mol·L-1)变化如下表所示:
2 min | 4 min | 6 min | |
CO | 0.07 | 0.05 | 0.05 |
H2 | x | 0.10 | 0.10 |
CH3OH | 0.03 | 0.05 | 0.05 |
①250 ℃时,该反应的平衡常数K=___________;
②在图1中画出反应开始至第6 min时H2的物质的量的变化曲线,并标出合适的纵坐标。_______
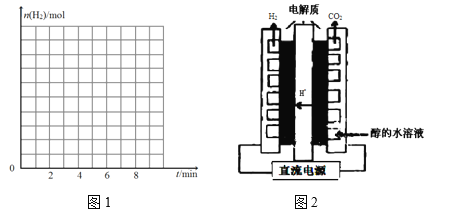
(4)利用电解甲醇水溶液制备氢气最大的优点就是需要的电压低,装置如图2,写出 阳极电极反应方程式____________________________________________________,电解的总反应化学方程式__________________________________________。
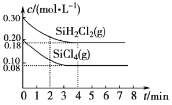
【题目】已知:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH=Q kJ·mol-1,其平衡常数随温度变化如表所示:
温度/k | 323 | 343 | 400 |
平衡常数 | 0.01 | 0.02 | 1 |
在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
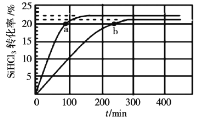
请回答下列问题:
(1)该反应的Q___0(填“>”或“<”)。
(2)代表323K曲线的是___(填a或b)
(3)在400K下,要缩短反应达到平衡的时间,可采取的措施有___、___。
(4)已知2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___。
=___。
(5)TK时在体积为10L的反应器中,通入一定量的SiH2Cl2(g)和SiCl4(g),发生上述反应,SiH2Cl2(g)和SiCl4(g)浓度变化如图所示,则0~4 min时平均反应速率v(SiCl4(g))=___。