题目内容
【题目】锂电池由于能量密度大逐渐取代锌电池。常用锂电池的正极材料为磷酸亚铁锂(LiFe-PO4),可采用FeCl3、NH4H2PO4、LiCl和苯胺等原料制备。回答下列问题:
(1)Fe基态原子核外电子排布式为___。
(2)已知Li2O是离子晶体,其晶格能的Born-Haber循环如图所示。
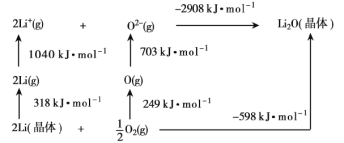
如图可知,Li原子的第一电离能为___kJ·mol-1,O=O键键能为___kJ·mol-1,Li2O晶格能为__kJ·moL-1。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
(4)NH4H2PO4中,P的杂化轨道类型为___。
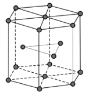
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为___。六棱柱底边边长为a cm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为___g·cm-3(列出计算式即可)。
【答案】1s22s22p63s23p63d64s2 520 498 2908 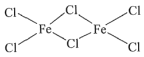 4 sp3 六方最密堆积
4 sp3 六方最密堆积 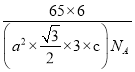
【解析】
(1)基态Fe原子核外电子数为26;
(2)Li原子的第一电离能为Li原子失去1个电子所需要的能量;O=O键键能为氧气分子变为氧原子所需能量;晶格能是气态离子形成1mol离子晶体释放的能量;
(3)蒸汽状态下以双聚分子存在的FeCl3,存在Fe-Cl键;
(4)磷酸根离子中P形成4个σ键;
(5)金属锌的这种堆积方式称为六方最密堆积,该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=
+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=![]() 。
。
(1)Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2;
(2)Li原子的第一电离能为Li原子失去1个电子所需要的能量,所以其第一电离能为![]() kJ/mol=520kJ/mol;O=O键键能为氧气分子变为氧原子所需能量,其键能=2×249kJ/mol=498kJ/mol;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ/mol;
kJ/mol=520kJ/mol;O=O键键能为氧气分子变为氧原子所需能量,其键能=2×249kJ/mol=498kJ/mol;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ/mol;
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为 ,Fe原子周围有4个Cl,则其中Fe的配位数为4;
,Fe原子周围有4个Cl,则其中Fe的配位数为4;
(4)NH4H2PO4中,磷酸根离子中P形成4个σ键,则P的杂化轨道形式为sp3;
(5)金属锌的这种堆积方式称为六方最密堆积,该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=
+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=![]() =
=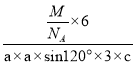 g/cm3=
g/cm3=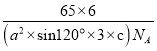 g/cm3或
g/cm3或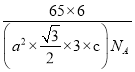 g/cm3。
g/cm3。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】已知:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH=Q kJ·mol-1,其平衡常数随温度变化如表所示:
温度/k | 323 | 343 | 400 |
平衡常数 | 0.01 | 0.02 | 1 |
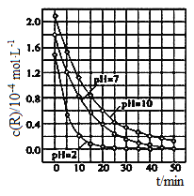
在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
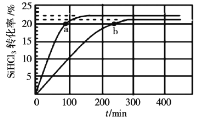
请回答下列问题:
(1)该反应的Q___0(填“>”或“<”)。
(2)代表323K曲线的是___(填a或b)
(3)在400K下,要缩短反应达到平衡的时间,可采取的措施有___、___。
(4)已知2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___。
=___。
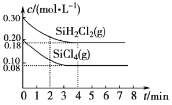
(5)TK时在体积为10L的反应器中,通入一定量的SiH2Cl2(g)和SiCl4(g),发生上述反应,SiH2Cl2(g)和SiCl4(g)浓度变化如图所示,则0~4 min时平均反应速率v(SiCl4(g))=___。
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11