题目内容
【题目】现有碳酸钠和碳酸氢钠的固体混合物,先取m g固体样品进行加热,完全分解产生CO2气体112 mL;另取m g固体样品溶于水,加入足量的盐酸时产生CO2 448 mL(气体体积均为标准状况下测定)。
(1)求m g混合物中碳酸氢钠与碳酸钠的物质的量各是多少?_________
(2)若产生448 mL CO2时,消耗盐酸的体积为300mL,则该盐酸的物质的量浓度是多少?____________
【答案】 0.01mol ,0.01mol 0.10 mol·L-1
【解析】完全分解产生CO2气体112 mL,物质的量为![]() =0.005mol,
=0.005mol,
2NaHCO3![]() Na2CO3 + CO2↑+H2O
Na2CO3 + CO2↑+H2O
0.01mol 0.005mol 0.005mol
根据加热分解产生的CO2体积可以计算样品中NaHCO3的物质的量为0.01mol,
加入足量的盐酸时产生CO2 448 mL,物质的量为![]() =0.02mol,
=0.02mol,
加入足量的稀盐酸时发生了如下反应:Na2CO3+2HCl=2NaCl+ CO2↑+H2O、HCl +NaHCO3= NaCl+CO2↑+H2O,根据碳元素守恒可知n(Na2CO3)=0.02mol-0.01mol=0.01mol,(1)m g混合物中碳酸氢钠与碳酸钠的物质的量均为0.01mol;(2)若产生448 mL CO2时,消耗盐酸的体积为300mL,因n(HCl)=0.01mol×2+0.01mol=0.03mol,c(HCl)= ![]() =0.10mol/L。
=0.10mol/L。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】试回答下列各题: 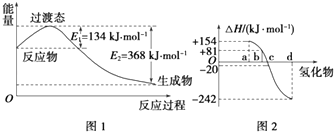
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJmol﹣1
请填空:
共价键 | H﹣H | Cl﹣Cl | H﹣Cl |
键能/(kJmol﹣1) | 436 | 247 |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: .
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25kJmol﹣1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣47kJmol﹣1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJmol﹣1③
请写出CO还原FeO的热化学方程式:
【题目】一定温度时,向2.0L恒容密闭容器中充入2molSO2和1molO2 , 发生反应:2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1s的平均速率v(O2)=0.4/t1molL﹣1s﹣1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.保持温度不变,向该容器中再充入0.3 molSO2、0.1molO2和0.2molSO3 , 则此时V正>V逆
D.相同温度下,起始时向容器中充入4mol SO3 , 达到平衡时,SO3的转化率大于10%