��Ŀ����
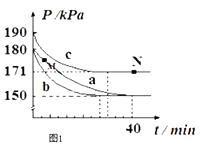
����Ŀ��һ���¶�ʱ����2.0L�����ܱ������г���2molSO2��1molO2 �� ������Ӧ��2SO2��g��+O2��g��2SO3��g��������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | t1 | t2 | t3 | t4 |
n��SO3��/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
����˵����ȷ���ǣ� ��
A.��Ӧ��ǰt1s��ƽ������v��O2��=0.4/t1molL��1s��1
B.���������������䣬���ѹ����1.0L��ƽ�ⳣ��������
C.�����¶Ȳ��䣬����������ٳ���0.3 molSO2��0.1molO2��0.2molSO3 �� ���ʱV����V��
D.��ͬ�¶��£���ʼʱ�������г���4mol SO3 �� �ﵽƽ��ʱ��SO3��ת���ʴ���10%
���𰸡�C
���������⣺A�����ݱ���������֪����n��SO3��=1.8mol���÷�Ӧ�ﵽƽ��״̬����Ӧ��ǰt1s��ƽ������v��SO3��= ![]() =0.4/t1molL��1s��1 �� �ٸ���ͬһ���淴Ӧ��ͬһ��ʱ���ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȼ���v��O2��=0.2/t1molL��1s��1 �� ��A����
=0.4/t1molL��1s��1 �� �ٸ���ͬһ���淴Ӧ��ͬһ��ʱ���ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȼ���v��O2��=0.2/t1molL��1s��1 �� ��A����
B����ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣬��ѹǿ������Ũ�ȶ��أ���B����
C����Ӧ�ﵽƽ��״̬ʱ��c��SO3��= ![]() =0.9mol/L��c��SO2��=
=0.9mol/L��c��SO2��= ![]() mol/L=0.1mol/L��c��O2��=
mol/L=0.1mol/L��c��O2��= ![]() mol/L=0.05mol/L����ѧƽ�ⳣ��K=
mol/L=0.05mol/L����ѧƽ�ⳣ��K= ![]() =1620��
=1620��
����������ٳ���0.3 molSO2��0.1molO2��0.2molSO3 �� c��SO3��=��0.9+ ![]() ��mol/L=1mol/L��c��SO2��=��0.1+
��mol/L=1mol/L��c��SO2��=��0.1+ ![]() ��mol/L=0.25mol/L��c��O2��=��0.05+
��mol/L=0.25mol/L��c��O2��=��0.05+ ![]() ��mol/L=0.1mol/L��Ũ����=
��mol/L=0.1mol/L��Ũ����= ![]() =160��1620����÷�Ӧ������Ӧ�����ƶ������ʱV����V�� �� ��C��ȷ��
=160��1620����÷�Ӧ������Ӧ�����ƶ������ʱV����V�� �� ��C��ȷ��
D����ͬ�¶��£���ʼʱ�������г���4mol SO3 �� �������������ȫת��Ϊ���������������������������������ʵ����ֱ���4mol��2mol��Ϊԭ����2��������ѹǿƽ�������ƶ������������ת�����������Զ�������ת���ʴ���90%����ͬ�¶��£���ʼʱ�������г���4mol SO3 �� �ﵽƽ��ʱ��SO3��ת����С��10%����D����
��ѡC��
A���ȼ�����������Ӧ���ʣ��ٸ���ͬһ���淴Ӧ��ͬһ��ʱ���ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȼ���v��O2����
B����ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣻
C���ȼ���Ũ���̣�����Ũ�����뻯ѧƽ�ⳣ����Դ�С�жϷ�Ӧ���Ӷ�ȷ�����淴Ӧ������Դ�С��
D����ͬ�¶��£���ʼʱ�������г���4mol SO3 �� �������������ȫת��Ϊ���������������������������������ʵ����ֱ���4mol��2mol��Ϊԭ����2��������ѹǿƽ�������ƶ������������ת��������