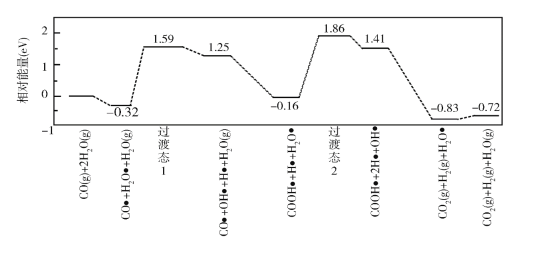
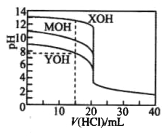
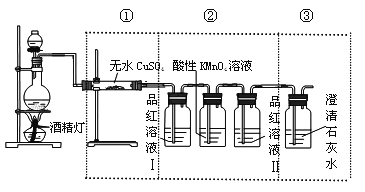
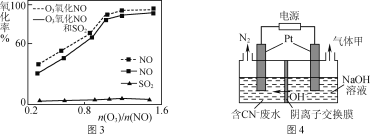
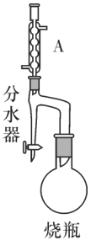
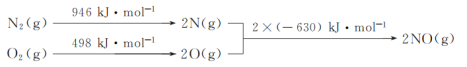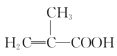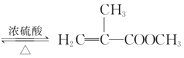题目内容
【题目】氮氧化物与悬浮在大气中海盐粒子的相互反应:4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) ![]() 在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol,NO2的转化率为![]() 。下列叙述中正确的是
。下列叙述中正确的是
A. 10min内NO浓度变化表示的速率υ(NO)=0.01mol·L-1·min-1
B. 若升高温度,平衡逆向移动,则该反应的![]()
C. 若起始时向该容器中充入0.1molNO2(g)、0.2molNO(g)和0.1molCl2(g)(固体物质足量),则反应将向逆反应方向进行
D. 若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率小于![]()
【答案】C
【解析】
A.10min反应达到平衡时n(NaNO3)=0.1mol,则n(NO)=0.1mol, ![]() =0.005molL1min1,A项错误;
=0.005molL1min1,A项错误;
B. 升高温度,平衡逆向移动,则该反应的△H<0,B项错误;
C. 根据上述条件,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol,则NO2的转化率为![]() =50%,可知列出三段式如下:
=50%,可知列出三段式如下:
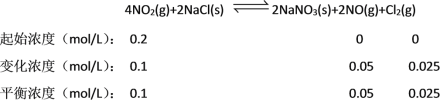
则平衡常数K=![]() =0.625,若起始时向该容器中充入0.1molNO2(g)、0.2molNO(g)和0.1molCl2(g),则各物质的浓度分别为:0.05mol/LNO2(g)、0.1mol/LNO(g)和0.05mol/LCl2(g),其浓度商Qc=
=0.625,若起始时向该容器中充入0.1molNO2(g)、0.2molNO(g)和0.1molCl2(g),则各物质的浓度分别为:0.05mol/LNO2(g)、0.1mol/LNO(g)和0.05mol/LCl2(g),其浓度商Qc=![]() =80>K,平衡向逆向移动,C项正确;
=80>K,平衡向逆向移动,C项正确;
D. 该反应体系是气体分子数减小的反应,若保持其他条件不变,在恒温恒容条件下NO2的转化率为![]() ,正反应气体体积减小,恒温恒压时,容器体积减小,相当于加压,平衡正向移动,平衡时NO2的转化率大于
,正反应气体体积减小,恒温恒压时,容器体积减小,相当于加压,平衡正向移动,平衡时NO2的转化率大于![]() ,D项错误;
,D项错误;
答案选C。