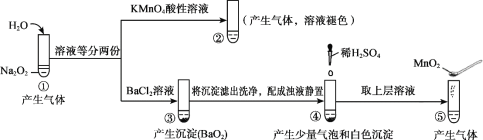
题目内容
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0,2SO2(g)+O2(g)
2NH3(g) △H<0,2SO2(g)+O2(g)![]() 2SO3(g) △H<0。请回答下列问题:
2SO3(g) △H<0。请回答下列问题:
(1)从影响化学反应速率和化学平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是_______。实际生产中采取的措施是_________。
(2)在合成氨的工业生产中,要分离出氨,目的是__________;而合成SO3的过程中,则不需要分离出SO3,原因是____________。
【答案】适当温度、高压、催化剂 合成氨:适当温度、高压、催化剂;合成SO3:适当温度、常压、催化剂 减小生成物的浓度,使平衡向生成NH3的方向移动 该反应向生成SO3的方向进行的程度较大,达到平衡后SO2剩余量较少,故不需要分离SO3
【解析】
工业上合成SO3与合成氨的最大不同之处是合成SO3是在常压下进行的,原因是在常压下该反应向生成SO3的方向进行的程度已经很大,采用高压虽能使平衡向生成SO3方向移动,但产生高压既需要动力又对反应容器耐压性有较高要求,综合生产成本和经济效益两方面因素,实际生产时,在常压下进行最合理。
(1)从化学反应速率看,化学速率越高,生产效率越高,因此温度较高,压强较大,使用催化剂;从化学平衡看来,平衡正向移动,转化率较高,温度越低,压强越大,有利于平衡正常移动,兼顾反应速率和平衡移动,结合理论上应该采取适当温度、高压、催化剂;
而实际上,合成氨采用的是适当温度、高压、催化剂,而合成SO3,在常压下,其向生成SO3的方向进行的程度已经很大,而增大压强,会增加生产成本,因此实际上,合成SO3采用的条件是:适当温度、常压、催化剂;
(2)将产物从反应体系中分离出来,有利于平衡正向移动,增加反应物的转化率,合成氨分离出氨气的目的是减小生成物的浓度,使平衡向生成NH3的方向移动;而再合成SO3的反应中,并不需要分离SO3,因为该反应向生成SO3的方向进行的程度较大,达到平衡后SO2剩余量较少。

 互动英语系列答案
互动英语系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量[(g·(100 mL)-1]。
(Ⅰ)实验步骤
(1)用___(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
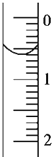
(3)读取盛装0.1000mol·L-1NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为___mL。
(4)滴定。当___时,停止滴定,并记录 NaOH溶液的终读数。重复滴定3次。
(Ⅱ)实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品)(mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗)(mL) | 15.95 | 15.00 | 15.05 | 14.95 |
(Ⅲ)数据处理与讨论
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=![]() mL=15.24mL,乙指出其计算不合理。按正确数据处理,可得市售白醋总酸量=____g·(100mL)-1;
mL=15.24mL,乙指出其计算不合理。按正确数据处理,可得市售白醋总酸量=____g·(100mL)-1;
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是___填写序号)。
a.碱式滴定管在滴定时用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
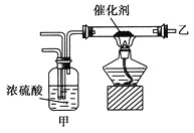
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。