题目内容
【题目】烟气中的氮氧化物是造成大气污染的重要因素。
(1)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
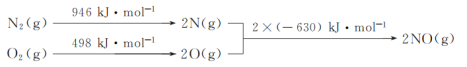
则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为___。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1所示。
①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____。
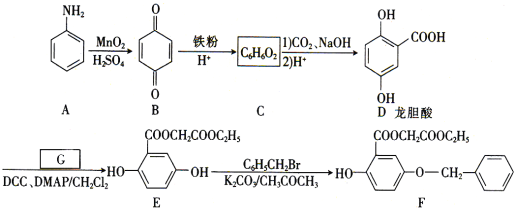
②NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示。请写出NO分解的化学方程式:______。

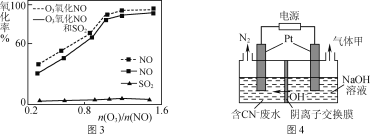
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验,实验结果如图3。
①同时脱硫脱硝时NO的氧化率略低的原因是____。
②由图3可知SO2对NO的氧化率影响很小的原因是_____。
(4)有人设想采用下列方法减少烟气中的氮氧化物对环境的污染:用天然气中的CH4、H2等还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NOx。请写出这种含硫化合物和NOx反应的化学方程式:_____。
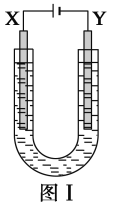
(5)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图4所示。电解池中生成N2的电极反应式为_____。
【答案】N2(g)+O2(g)=2NO(g);ΔH=+184 kJ·mol-1 NO的分解反应是放热反应,升温有利于反应逆向进行 3NO![]() N2O+NO2 SO2的氧化消耗了少量O3,减小了O3的浓度 O3氧化SO2反应的活化能较大,O3与NO反应速率比O3与SO2反应速率快 2xH2S+2NOx=N2+2xH2O+2xS 2CN-+12OH--10e-=2CO32-+N2↑+6H2O
N2O+NO2 SO2的氧化消耗了少量O3,减小了O3的浓度 O3氧化SO2反应的活化能较大,O3与NO反应速率比O3与SO2反应速率快 2xH2S+2NOx=N2+2xH2O+2xS 2CN-+12OH--10e-=2CO32-+N2↑+6H2O
【解析】
(1)根据反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
(2) 温度超过775 K,发现NO的分解率降低,说明平衡向逆反应方向移动;NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图像可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物书写方程式;
(3)SO2与O3反应导致减小了O3的浓度;SO2对NO的氧化率影响很小,说明臭氧与NO更易反应;
(4) 用天然气中的CH4、H2等还原SO2,S元素化合价降低,在含硫质量分数约为94%的化合物S显-2价,结合质量守恒判断该化合物的化学式,据此分析解答;
(5)由装置图可知,左边为阳极为CN-失电子生成氮气的反应,由此书写电极反应式。
(1)该反应中的反应热=反应物的键能之和-生成物的键能之和=(946+498)kJ/mol-2×630kJ/mol=+184kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g) △H=+184kJmol-1;故答案为:N2(g)+O2(g)=2NO(g) △H=+184kJmol-1;
(2)①若不使用CO,温度超过775 K,发现NO的分解率降低,说明平衡向逆反应方向移动,则该反应正反应为放热反应,故答案为:该反应是放热反应,升高温度反应更有利于向逆反应方向进行;
②NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图像可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2,所以方程式为3NO![]() N2O+NO2,故答案为:3NO
N2O+NO2,故答案为:3NO![]() N2O+NO2
N2O+NO2
(3)①SO2与O3反应,减小了O3的浓度,从而使NO的氧化率略低,故答案为:SO2的氧化消耗了少量O3,减小了O3的浓度;
②SO2对NO的氧化率影响很小,说明臭氧与NO更易反应,可说明O3氧化SO2反应的活化能较大,O3与NO反应速率比O3与SO2反应速率快,故答案为:SO2的氧化消耗了少量O3,减小了O3的浓度;O3氧化SO2反应的活化能较大,O3与NO反应速率比O3与SO2反应速率快;
(4) 用天然气中的CH4、H2等还原SO2,S元素化合价降低,从产物中分离出一种含硫质量分数约为94%的化合物,根据质量守恒,该化合物只能含有H和S元素,为H2S,H2S还原NOx生成氮气和硫,反应的方程式为2xH2S+2NOx=N2+2xH2O+2xS,故答案为:2xH2S+2NOx=N2+2xH2O+2xS;
(5)根据图像,左边电极上CN-转变为N2,失去电子,发生氧化反应,CN-失电子生成氮气,因为溶液显碱性,因此电极反应式为:2CN-+12OH--10e-=2CO32-+N2↑+6H2O,故答案为:2CN-+12OH--10e-=2CO32-+N2↑+6H2O。

 阅读快车系列答案
阅读快车系列答案【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出