题目内容
6.印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2.(1)反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.当有0.2mol Cu反应时,转移的电子数目为0.4NA
(2)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是AD.(填序号)
A.氯气 B.稀硫酸 C.铁 D.双氧水
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3+2KI=2FeCl2+I2+2KCl.标出该反应电子转移的方向和数目:
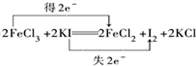 .向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为紫色,再将混合液倒入分液漏斗(填仪器名称)中,将两层液体分离.
.向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为紫色,再将混合液倒入分液漏斗(填仪器名称)中,将两层液体分离.
分析 (1)Fe3+与Cu反应发生氧化还原反应,根据有1mol Cu反应时,转移的电子数目为2mol分析;
(2)将Fe2+转化为Fe3+,被氧化,应加氧化剂;
(3)根据碘单质易溶于CCl4溶液,而CCl4溶液与水不互溶并且密度比水大来分析.
解答 解:(1)Fe3+与Cu反应发生氧化还原反应,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,则有1molCu反应时,转移的电子数目为2mol,所以有0.2mol Cu反应时,转移的电子数目为0.4NA,故答案为:2Fe3++Cu=2Fe2++Cu2+;0.4NA;
(2)将Fe2+转化为Fe3+,被氧化,应加氧化剂四个选项中充当氧剂的是氯气和双氧水,故选AD;
(3)2FeCl3+2KI═2FeCl2+I2+2KCl,用双线桥法标出该反应电子转移的方向和数目为 ;
;
因为碘单质易溶于CCl4溶液,而CCl4溶液与水不互溶并且密度比水大,所以下层液体的颜色为紫色,混合液倒入分液漏斗将其分离;
故答案为: ;紫;分液漏斗.
;紫;分液漏斗.
点评 本题考查了氧化还原反应的概念分析判断,元素化合价的变化分析是解题关键,强弱规律的掌握和电子转移的标注需要熟练掌握基础知识.

练习册系列答案
相关题目
17.有质量分数为a的氨水溶液,蒸发掉原溶液质量一半的水后,浓度从C1mol/L变成C2mol/L,下列说法正确的是( )
| A. | C2=2C1 | B. | C2>2C1 | C. | C2<2C1 | D. | C2=a |
14.下列各组物质中,X表示某物质,Y表示X物质中含有的少量杂质,Z表示要除去杂质加入的试剂,其中正确的组别是( )
| X | Y | Z | |
| A | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B | Fe粉 | A1粉 | NaOH溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | C12 |
| D | SiO2 | Fe2O3 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
11.“熵”可看作是“混乱度”,它的符号是“S”.下列变化中,△S<0(“混乱度”减小)的是( )
| A. | 3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g) | B. | 2NO2(g)═N2O4(l) | ||
| C. | 2IBr(l)═I2(s)+Br2(g) | D. | (NH4)2CO3(s)═2NH3(g)+CO2(g)+2H2O(g) |
18.在无土培植中,需用0.5mol•L-1NH4Cl、0.16mol•L-1KCl、0.24mol•L-1 K2SO4的营养液,若用KCl、NH4Cl、(NH4)2SO4三种固体配制1L营养液,则需此三种固体的物质的量为( )
| A. | 0.4 mol 0.5 mol 0.12 mol | B. | 0.64 mol 0.02 mol 0.24 mol | ||
| C. | 0.64 mol 0.5 mol 0.24 mol | D. | 0.66 mol 0.5 mol 0.24 mol |
2.下列关于水玻璃的性质和用途的叙述中正确的是( )
| A. | 它是一种纯净物,既不燃烧也不易腐蚀 | |
| B. | 水玻璃是生产玻璃的主要原料之一 | |
| C. | 木柴、织物浸过水玻璃具有防腐性能且不易燃烧 | |
| D. | 水玻璃的化学性质稳定,在空气中不易变质 |