题目内容
16.实验室里迅速制备少量氯气可利用以下反应:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高.
(1)用“单线桥法”表示出电子转移情况:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(2)该反应中,氧化剂是KMnO4,还原剂是HCl.
(3)当电子转移的数目为6.02×1023个时,求生成的氯气的物质的量和被氧化的HCl的质量.
(写出计算过程)
分析 (1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,据此解答;
(2)所含元素化合价升高的是还原剂,所含元素化合价降低的是氧化剂;
(3)反应中氯元素化合价由-1价升高为0价,令生成的氯气的物质的量为xmol,根据电子转移列放出计算x的值,再根据Cl原子守恒可知,计算被氧化的HCl的质量.
解答 解:(1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表,反应中电子转移的方向和数目为: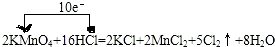 ;
;
故答案为: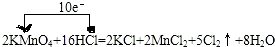 ;
;
(2)Mn元素的化合价降低,Cl元素的化合价升高,则KMnO4为氧化剂,HCl为还原剂,故答案为:KMnO4;HCl;
(3)当电子转移的数目为6.02×1023个时,即转移1mol电子,生成的氯气的物质的量为1mol×$\frac{5}{10}$=0.5mol,由Cl原子守恒可知,被氧化的HCl的质量为0.5mol×2×36.5g/mol=36.5g,答:生成的氯气的物质的量为0.5mol,被氧化的HCl的质量为36.5g
点评 本题考查氧化还原反应的计算,难度不大,注意氧化还原反应中根据化合价进行的有关计算,掌握电子转移的表示方法.

练习册系列答案
相关题目
6.将乙烯和氧气的混合气体,用电火花不断引燃,使乙烯完全燃烧(氧气过量).在120℃时测得反应后的混合气体对H2的相对密度是14.75.则原混合气体中乙烯和氧气的体积比为( )
| A. | 1:3 | B. | 1:7 | C. | 1:1 | D. | 5:3 |
7.结晶玫瑰是具有强烈玫瑰香气的香料,可由如图反应路线合成:
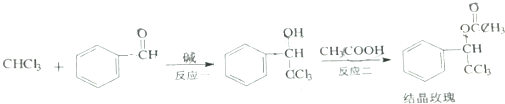
关于如图合成过程下列说法不正确的是( )

关于如图合成过程下列说法不正确的是( )
| A. | 反应一是加成反应 | |
| B. | 反应二的发生可用浓硫酸做催化剂 | |
| C. | 结晶玫瑰分子式为C10H9Cl3O2 | |
| D. | 上述过程中所有有机物的官能团共有6种 |
4.下列叙述中,不能用平衡移动原理解释的是( )
| A. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| B. | 粉末状硫磺比块状硫磺在氧气中燃烧剧烈 | |
| C. | 高压比常压有利于合成SO3的反应 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
11.只用水就能鉴别的一组物质是( )
| A. | 苯、乙酸、四氯化碳 | B. | 乙醇、乙醛、乙酸 | ||
| C. | 乙醛、乙二醇、甲酸 | D. | 乙酸乙酯、乙醇、甘油 |
1.1803年提出原子学说,为近代化学发展奠定了坚实基础的化学家是( )
| A. | 英国的道尔顿 | B. | 法国的拉瓦锡 | C. | 俄国的门捷列夫 | D. | 英国的波义耳 |
8.已知氯元素的近似相对原子质量为35.5,由23Na和35Cl及37Cl构成的25g纯NaCl中含Na35Cl的质量是( )
| A. | 18.75g | B. | 18.59g | C. | 26.1g | D. | 26.33g |
5.下列叙述正确的是( )
| A. | Na在氧气中燃烧主要生成Na2O | |
| B. | 将CO2通入次氯酸钙溶液可生成次氯酸 | |
| C. | 将SO2通入BaCl2溶液可生成BaSO3沉淀 | |
| D. | 将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
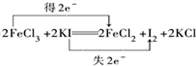 .向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为紫色,再将混合液倒入分液漏斗(填仪器名称)中,将两层液体分离.
.向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为紫色,再将混合液倒入分液漏斗(填仪器名称)中,将两层液体分离.