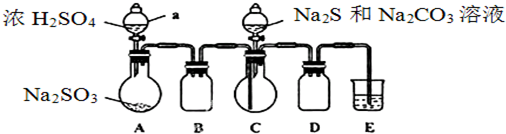
题目内容
18.某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )| A. |  如果MnO2过量,浓盐酸就可全部消耗 | |
| B. |  量筒中发生了取代反应 | |
| C. |  生成蓝色的烟 | |
| D. |  干燥的有色布条褪色,说明氯气有漂白性 |
分析 A、从浓盐酸随着反应进行浓度减小后不与二氧化锰继续反应分析判断;
B、发生取代反应生成HCl,HCl极易溶于水;
C、铜在氯气中燃烧产生棕色的烟分析;
D、干燥的有色布条不褪色.
解答 解:A、如果MnO2过量,浓盐酸随着反应进行,浓度减小到一定程度,不再与二氧化锰继续反应,所以盐酸不能全部消耗,故A错误;
B、甲烷与氯气发生取代反应,生成的HCl极易溶于水,则量筒中气体颜色变浅,液面上升,故B正确;
C、铜在氯气中燃烧产生棕色的烟,故C错误;
D、干燥的有色布条不褪色,而湿润的有色布条能褪色,是因为氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,使有色布条褪色,剩余氯气通入到盛氢氧化钠溶液的烧杯中发生反应为,Cl2+2NaOH=NaCl+NaClO+H2O,将硫酸溶液滴入烧杯中,至溶液显酸性,氯化钠和次氯酸钠会发生氧化还原反应,离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O,所以结果有Cl2生成,故D错误;
故选B.
点评 本题考查了实验基本操作的装置、现象、原理,主要是物质化学性质的具体应用,关键是明确氯化钠和次氯酸钠在酸溶液中的氧化还原反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列图示实验正确的是( )
| A. |  除去粗盐溶液中的不溶物 | B. |  碳酸氢钠受热分解 | ||
| C. | 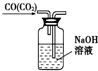 除去CO气体中的CO2气体 | D. |  乙酸乙酯制备演示实验 |
6. 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
已知①A、B、C、D、G含有同种元素.
②
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G.
依据以上信息填空:
(1)写出D的化学式:Fe2O3.
(2)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色,写出该变化的化学方程式FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)写出反应A转化为B的化学方程式:2Fe+3Cl2=2FeCl3.
(4)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.如何检验该反应生成的金属阳离子,简述操作方法及现象取反应后溶液少量滴入酸性高锰酸钾,若紫红色褪去,或滴入铁氰化钾生成蓝色沉淀即证明生成Fe2+离子.
 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:已知①A、B、C、D、G含有同种元素.
②
| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 棕黄色 | 红棕色 | 浅绿色 |
依据以上信息填空:
(1)写出D的化学式:Fe2O3.
(2)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色,写出该变化的化学方程式FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)写出反应A转化为B的化学方程式:2Fe+3Cl2=2FeCl3.
(4)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.如何检验该反应生成的金属阳离子,简述操作方法及现象取反应后溶液少量滴入酸性高锰酸钾,若紫红色褪去,或滴入铁氰化钾生成蓝色沉淀即证明生成Fe2+离子.
3.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用.下列化学反应,不符合绿色化学概念的是( )
| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 制CuSO4:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CuO+H2SO4(稀)═CuSO4+H2O |
10.
I:(1)第三周期元素M的电离能情况如甲图A所示.则M元素的价层电子排布式是3s2
(2)图B折线c(选填“a”、“b”或“c”)可以表达出第ⅣA族元素氢化物的沸点的变化规律.其中点A表示的分子的化学式为H2O,其沸点较高是因为水分子间可以形成氢键.
(3)COCl2 俗称光气,分子中C原子采取sp2杂化成键;其中分子中的共价键含有C(填序号):
A 2个σ键 1个π键 B 2个键π C 3个σ键、1个π键
Ⅱ:海水中富含氯元素.
(4)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-电子排布式为1s22s22p63s23p6
(5)下列是IA族的Li、Na、K三种金属元素的电离能
则三种金属的氯化物(RCl)的熔点由高到低的顺序为LiCl>NaCl>KCl(用化学式回答),原因是随核电荷数增大,阳离子半径增大,晶格能减小,熔点降低
(6)RCl用作有机机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图乙所示.R的元素符号是Cu,每个Cl-周围最近的Cl-12个.已知该晶体密度为1.15 g/cm3,则晶胞中最近的R+和Cl-之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{1.15×6.02×1{0}^{23}}}$cm(NA=6.02×1023/mol,只写出计算表达式即可)

I:(1)第三周期元素M的电离能情况如甲图A所示.则M元素的价层电子排布式是3s2
(2)图B折线c(选填“a”、“b”或“c”)可以表达出第ⅣA族元素氢化物的沸点的变化规律.其中点A表示的分子的化学式为H2O,其沸点较高是因为水分子间可以形成氢键.
(3)COCl2 俗称光气,分子中C原子采取sp2杂化成键;其中分子中的共价键含有C(填序号):
A 2个σ键 1个π键 B 2个键π C 3个σ键、1个π键
Ⅱ:海水中富含氯元素.
(4)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-电子排布式为1s22s22p63s23p6
(5)下列是IA族的Li、Na、K三种金属元素的电离能
| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
(6)RCl用作有机机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图乙所示.R的元素符号是Cu,每个Cl-周围最近的Cl-12个.已知该晶体密度为1.15 g/cm3,则晶胞中最近的R+和Cl-之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{1.15×6.02×1{0}^{23}}}$cm(NA=6.02×1023/mol,只写出计算表达式即可)
7.下列物质中,不能电离出酸根离子的是( )
| A. | Na2CO3 | B. | KNO3 | C. | KOH | D. | H2SO4 |
8.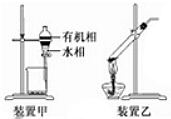 下列实验操作正确的是( )
下列实验操作正确的是( )
 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
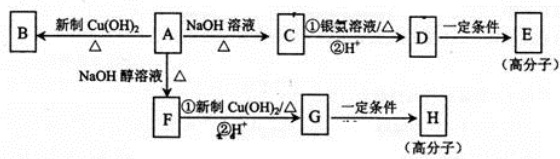
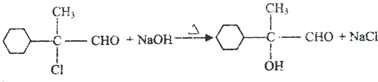 .
.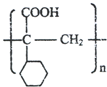 ,E的结构简式是
,E的结构简式是 .
.