题目内容
1.A、B、C、D、E是五种常见的单质或化合物.它们之间有如下转化关系.其中反应①是置换反应、反应②是化合反应.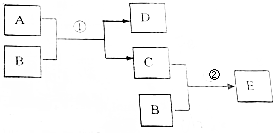
(1)若A是金属单质,C非金属单质.试推断:
①化合物E化学式是CO.
②A与B反应的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO.
(2)若B是具有氧化性的黄绿色气体单质,E溶液中滴入2-3滴KSCN溶液,溶液呈血红色.试推断:
①写出A物质的化学式FeI2.
②写出B与足量的A在溶液中反应的离子方程式2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-.
分析 (1)若A是金属单质,C非金属单质,由转化关系可知B被还原生成C,C可与B化合反应生成另一种化合物E,则C单质对应的元素应存在多种化合价,则A和B的反应应为Mg和CO2的反应,A为Mg,B为CO2,C为C,D为MgO,E为CO;
(2)若B是具有氧化性的黄绿色气体单质,应为Cl2,E溶液中滴入2-3滴KSCN溶液,溶液呈血红色,则E为FeCl3,则C为FeCl2,可知A为FeI2,D为I2,以此解答该题.
解答 解:(1)若A是金属单质,C非金属单质,由转化关系可知B被还原生成C,C可与B化合反应生成另一种化合物E,则C单质对应的元素应存在多种化合价,则A和B的反应应为Mg和CO2的反应,A为Mg,B为CO2,C为C,D为MgO,E为CO,
①由以上分析可知E为CO,故答案为:CO;
②A与B反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO;
(2)若B是具有氧化性的黄绿色气体单质,应为Cl2,E溶液中滴入2-3滴KSCN溶液,溶液呈血红色,则E为FeCl3,则C为FeCl2,可知A为FeI2,D为I2,
①由以上分析可知A为FeI2,故答案为:FeI2;
②B与足量的A在溶液中反应,亚铁离子和电离子全部被氧化,反应的离子方程式为2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,
故答案为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-.
点评 本题考查无机物的推断,为高频考点和常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,本题注意把握反应的类型和转化关系,注意相关基础知识的积累,难度中等.

途径①Fe$\stackrel{稀HCl}{→}$FeCl2溶液 途径②Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe、水}{→}$FeCl2溶液
途径③Cl2$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液 途径④Cl2$\stackrel{NaOH溶液}{→}$NaCIO溶液$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径⑤S$\stackrel{弄HNO_{3}}{→}$ H2SO4 途径⑥S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4.
| A. | 由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- | |
| B. | 由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 molCl2,各转移2mole- | |
| C. | 由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1molS,各转移6mole- | |
| D. | 以上说法都不正确 |
| A. | 用胶头滴管取少量液体试剂 | B. | 用纸槽向试管底部加入粉未状药品 | ||
| C. | 用燃着的酒精灯点燃另一盞酒精灯 | D. | 用排水法收集难溶于水的气体 |
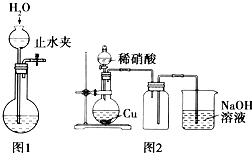
| A. | 用广泛pH试纸测得饱和氯水的pH约为2.2 | |
| B. | 用量筒量取7.60 mL 0.1 mol•L-1盐酸 | |
| C. | 用图1所示的操作可检查装置的气密性 | |
| D. | 实验室用图2所示的装置制取少量的NO |
| A. | Na2CO3溶液和稀盐酸 | B. | NaHCO3溶液和稀盐酸 | ||
| C. | AlCl3溶液和NH3•H20溶液 | D. | 澄清石灰水和NaHCO3溶液 |
| A. | 过滤时,液面超过滤纸的边缘 | |
| B. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| C. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| D. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 |
 .
.