题目内容
7.实验室利用饱和NaNO2溶液(12mol/L)和NH4Cl溶液加热制备N2.(1)若配制250mL上述NaNO2溶液需要的玻璃仪器为250ml容量瓶、烧杯、玻璃棒、胶头滴管,可用排水法收集N2
(2)写出上述实验原理的离子方程式并标出电子转移的数目和方向(单线桥法或双线桥法都可)
 .
.
分析 (1)配制一定物质的量浓度的溶液需要的玻璃仪器为250ml容量瓶、烧杯、玻璃棒、胶头滴管,制备得到的氮气难溶于水可以用排水法收集;
(2)氯化铵和亚硝酸钠发生氧化还原反应,氮元素化合价-3价变化为0价,+3价变化为0价,发生归中反应生成氮气、氯化钠和水,电子转移总数为3,用单线桥或双线桥标注电子转移总数.
解答 解:(1)配制一定物质的量浓度的溶液需要的玻璃仪器为250ml容量瓶、烧杯、玻璃棒、胶头滴管,制备得到的氮气难溶于水可以用排水法收集,
故答案为:250ml容量瓶、烧杯、玻璃棒、胶头滴管;排水;
(2)氯化铵和亚硝酸钠发生氧化还原反应,氮元素化合价-3价变化为0价,+3价变化为0价,发生归中反应生成氮气、氯化钠和水,电子转移总数为3,用单线桥或双线桥标注电子转移总数,即 .故答案为:
.故答案为: .
.
点评 本题考查了氧化还原反应电子转移标注方法,溶液配制过程,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
4.NA 表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 1mol 12C原子的质量是12g,1个12C原子的质量是$\frac{12}{{N}_{A}}$g | |
| B. | 在常温常压下,11.2LN2含有分子数为0.5NA | |
| C. | 18g水所含有的氢原子数目为2NA,氧原子数目为NA | |
| D. | 1L 0.1mol•L-1K2SO4溶液中,K+ 和SO42-的离子总数是0.3NA |
2. 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )| A. | a电极为阴极 | |
| B. | a电极产生的气泡中主要成分是氯气 | |
| C. | 通电时,O2-、Cl-等向阴极移动 | |
| D. | 该制备工艺中需要定期更换石墨棒 |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 18g重水含有10NA个电子 | |
| B. | 室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数约为3NA | |
| C. | 常温下0.05mol•L-1Fe2(SO4 ) 3溶液中含Fe 3+数目小于0.1NA | |
| D. | 用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4L气体 |
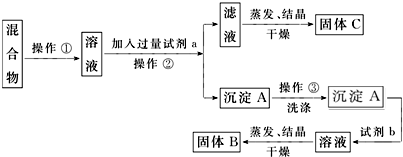
16.某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO${\;}_{4}^{2-}$)中提取铬.

有关数据如表:
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO4•7H2O,酸性工业废液中加入适量氧化铝的作用是调节溶液的pH.
(2)若酸性废液中c(Mg2+)=0.lmol.L-l,为达到步骤①的实验目的,则废液的pH应保持在(5.3,7.8)范围(保留小数点后l位).
(3)步骤②中生成NaCrO2的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O.
(4)步骤④中反应的离子方程式为7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-.
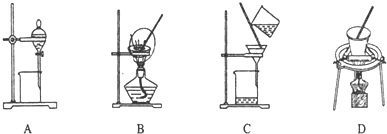
(5)步骤⑤在空气中充分灼烧的目的是使Cr(OH)3完全转化为Cr2O3,可选用的装置是D(填序号).
(6)用如图所示装置制取铬酸钠(Na2CrO4),回答相关问题.
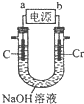
①a是电源的负极,阳极的电极反应式为Cr-6e-+8OH-=CrO42-+4H2O.
②若电解一段时间后阴极收集到标准状况下的气体3.36L,则理论上可制得8.1g铬酸钠(忽略反应2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(1)的影响)

有关数据如表:
| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的Ph | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
(1)步骤①所得滤液可用于制取MgSO4•7H2O,酸性工业废液中加入适量氧化铝的作用是调节溶液的pH.
(2)若酸性废液中c(Mg2+)=0.lmol.L-l,为达到步骤①的实验目的,则废液的pH应保持在(5.3,7.8)范围(保留小数点后l位).
(3)步骤②中生成NaCrO2的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O.
(4)步骤④中反应的离子方程式为7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-.
(5)步骤⑤在空气中充分灼烧的目的是使Cr(OH)3完全转化为Cr2O3,可选用的装置是D(填序号).

(6)用如图所示装置制取铬酸钠(Na2CrO4),回答相关问题.

①a是电源的负极,阳极的电极反应式为Cr-6e-+8OH-=CrO42-+4H2O.
②若电解一段时间后阴极收集到标准状况下的气体3.36L,则理论上可制得8.1g铬酸钠(忽略反应2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(1)的影响)