题目内容
【题目】硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含SiO2、A12O3、少量Fe2O3 等)为原料制备硫酸铝晶体[Al2(SO4)3·18H2O]的实验流程如图所示。
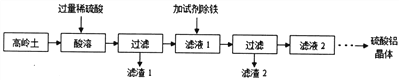
回答以下问题
(1)高岭土需进行粉粹,粉粹的目的是_____________________。
(2)滤渣1经过处理可作为制备水玻璃(Na2SiO3水溶液)的原料,写出滤渣1与烧碱溶液反应的化学方程式____________________________________。
(3)加入试剂除铁前,滤液1中的阳离子除了Al3+、Fe3+外还有的阳离子是__________(填离子符号)。滤渣2主要成分为Fe(OH)3,由于条件控制不当,常使Fe(OH)3 中混有Al(OH)3影响其回收利用,用离子方程式表示除去A1(OH)3的原理____________________________________________。
(4)检验滤液2中是否含有Fe3+的实验方法是(要求写出实验步骤和现象):__________________。
(5)要从滤液2获取硫酸铝晶体需要经过多步处理,其中从溶液中得到晶体的方法是__________(填标号)。
a.蒸发结晶 b.蒸发浓缩、冷却结晶
(6)某兴趣小组为了测定晶体中Al2(SO4)3·18H2O(M=666g·mol-1)的质量分数,进行如下实验:
①准确称取l.00g晶体样品,溶于一定量水中;
②滴入0.100 mol·L-1 EDTA溶液,与Al3+反应所消耗EDTA溶液的体积25.00 mL。 (已知:EDTA与Al3+以物质的量之比1∶1反应,假设杂质不与EDTA反应)则晶体中Al2(SO4)3·18H2O的质量分数是__________;若样品中的杂质离子能与EDTA反应,所测定质量分数将会__________(填“偏高”、“偏低”或“无影响”)。
【答案】 加大反应接触面积,加快反应速率,使反应充分 SiO2+2NaOH=Na2SiO3+H2O H+ Al(OH)3+OH-=[Al(OH)4]- 取少量滤液2于试管中,滴加少量KSCN溶液,若溶液变为血红色,则含有铁离子,反之则无 B 83.25% 偏高
【解析】本题靠擦汗化学工艺流程,(1)粉碎高岭土,增加与硫酸的接触面积,加快反应速率,使反应充分;(2)SiO2是酸性氧化物,不与硫酸反应,氧化铝是两性氧化物,与硫酸反应生成Al2(SO4)3,Fe2O3是碱性氧化物,与硫酸反应生成Fe2(SO4)3,因此滤渣1为SiO2,与烧碱反应的化学反应方程式为SiO2+2NaOH=Na2SiO3+H2O;((3)根据流程,酸溶加入硫酸是过量,以及(2)的分析,溶液中阳离子有Al3+、Fe3+和H+,氢氧化铝为两性氧化物,氢氧化铁为碱,因此除去氢氧化铝,用NaOH溶液,因此反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O或Al(OH)3+OH-=[Al(OH)4]-;(4)检验Fe3+一般有KSCN溶液,如果溶液变红,说明含有Fe3+,具体操作是取少量滤液2于试管中,滴加少量KSCN溶液,若溶液变为血红色,则含有铁离子,反之则无;(5)得到硫酸铝晶体中含有结晶水,因此采用蒸发浓度、冷却结晶的方法得到,蒸发结晶,容易失去结晶水,故B正确;(6)EDTA与Al33+:1反应,因此硫酸铝的物质的量为25×10-3×0.1/2mol=1.25×10-3mol,其质量为1.25×10-3×666g=0.8325g,质量分数为0.8325/1×100%=83.25%,如果杂质与EDTA反应,消耗EDTA的体积增多,求的Al3+的物质的量增大,即质量分数偏高。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案