题目内容
14.在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,当有8.7gMnO2参加反应时,下列说法正确的是( )| A. | 被氧化的HCl为0.4mol | B. | 转移的电子数为0.2NA | ||
| C. | 该反应中HCl只作还原剂 | D. | Cl2为还原产物 |
分析 由方程式可知,当有1molMnO2参加反应,有4molHCl参加反应,但生成1molCl2,说明有2molHCl被氧化,n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,结合方程式计算.
解答 解:n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑被氧化HCl
1 4 2
0.1mol 0.4mol 0.2mol
A.被氧化的HCl为0.2mol,故A错误;
B.氧化0.2molHCl,Cl元素化合价由-1价升高到0价,转移的电子数为0.2NA,故B正确;
C.反应中只有部分Cl元素化合价变化,HCl起到还原剂和酸性的作用,故C错误;
D.Cl元素化合价升高,被氧化,则Cl2为氧化产物,故D错误.
故选B.
点评 本题考查氧化还原反应的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握元素的化合价的变化,为解答该题的关键,答题注意注意结合方程式计算,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列实验中,能达到预期目的是( )
| A. | 用过滤法除去Fe(OH)3胶体中的FeCl3 | |
| B. | 用25mL碱式滴定管量取20.10mLNa2CO3溶液 | |
| C. | 将SO2通入酸性KMnO4溶液中,可证明SO2具有漂白性 | |
| D. | 欲鉴别AlC13溶液和AgNO3溶液,向2种待测液中分别滴加足量氨水 |
5.下列说法,可以说明在固定容积的密闭容器中,反应N2(g)+3H2(g)?2NH3(g)已达到化学平衡状态的是( )
| A. | 1个N≡N键断裂的同时,有2个N-H键断裂 | |
| B. | 3V正(N2)=V逆(H2) | |
| C. | 容器内混合气体的密度不再变化 | |
| D. | 容器内N2、H2、NH3的浓度比为1:3:2 |
2.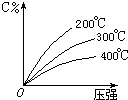 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 化学方程式中n>e+f | |
| C. | 达平衡后,若升温,平衡右移 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
9.已知有如下反应:①2BrO3-+Cl2═Br2+2ClO3-,②2FeCl2+Cl2═2FeCl3 ③ClO3-+5Cl-+6H+═3Cl2+3H2O,④2FeCl3+2KI═2FeCl2+2KCl+I2,下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl 2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
19.下列广告语中,你认为符合科学道理的是( )
| A. | “超纯水”、“超纯蒸馏水”绝对卫生,对人体有益 | |
| B. | 含碘食盐可防治甲状腺肿大,但也不能滥补,造成体内碘含量过高 | |
| C. | 本饮料由纯天然物质配置而成,绝对不含化学物质,对人体无害 | |
| D. | 含氟牙膏可适合任何人群预防龋齿 |
6.已知,向Zn2+离子溶液中滴加氨水,生成Zn(OH)2白色沉淀;但是氨水过量时,沉淀又溶解,生成了Zn(NH3)42+.此外,Zn(OH)2既可溶于盐酸,也可溶于过量NaOH溶液中,生成ZnO22-,所以Zn(OH)2是一种两性氢氧化物.
现有4组离子,每组有2种金属离子.可供选用的试剂有:A硫酸B盐酸 C硝酸 D氢氧化钠溶液 E氨水,选择合适试剂可以让一种离子沉淀一种离子保留在溶液中.
试填空:通过合理选择试剂后将两离子分开后保留在溶液中的离子实际存在形式的符号
现有4组离子,每组有2种金属离子.可供选用的试剂有:A硫酸B盐酸 C硝酸 D氢氧化钠溶液 E氨水,选择合适试剂可以让一种离子沉淀一种离子保留在溶液中.
试填空:通过合理选择试剂后将两离子分开后保留在溶液中的离子实际存在形式的符号
| 离子组 | 保留在溶液中的离子 |
| 1Zn2+和Al3+ | |
| 2Zn2+和Mg2+ | |
| 3Zn2+和Ba2+ | |
| 4Fe3+和Al3+ |
3.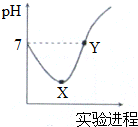 常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )| A. | X、Y两点所示溶液中含有微粒的种类前者多 | |
| B. | X、Y两点所示溶液中水的电离程度前者大 | |
| C. | Y点所示溶液中存在c(Na+)=c(HClO)+2c(ClO-) | |
| D. | X点所示溶液中发生反应的离子方程式为Cl2+H2O═2 H++Cl-+ClO- |
4.某温度下,在容积一定的密闭容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度不变,向容器中再加入1mol A、0.5mol B和1mol C,则下列说法正确的是( )
| A. | 正、逆反应速率都增大,平衡不移动 | |
| B. | 正、逆反应速率都不变,平衡不移动 | |
| C. | 正、逆反应速率都增大,平衡向左移动 | |
| D. | 正、逆反应速率都增大,平衡向右移动 |