题目内容
3.对反应 4NH3+5O2═4NO+6H2O,下列反应速率的最快的是( )| A. | v(NH3)=0.25 mol•L-1•min-1 | B. | v(O2)=0.35mol•L-1•min-1 | ||
| C. | v(NO)=0.01 mol•L-1•s-1 | D. | v(H2O)=0.3 mol•L-1•min-1 |
分析 化学反应速率与化学计量数之比越大,则反应速率越快,以此来解答.
解答 解:化学反应速率与化学计量数之比越大,则反应速率越快,
A.$\frac{0.25}{4}$=0.0625;
B.$\frac{0.35}{5}$=0.07;
C.v(NO)=0.01 mol•L-1•s-1=0.6 mol•L-1•min-1,$\frac{0.6}{4}$=0.15;
D.$\frac{0.3}{6}$=0.05,
所以反应速率大小顺序是C>B>A>C,则反应速率最快的是C,故选C.
点评 本题考查化学反应速率快慢比较,明确同一可逆反应中各物质反应速率与计量数关系即可解答,易错选项是C,注意比较反应速率单位要统一,为易错题.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
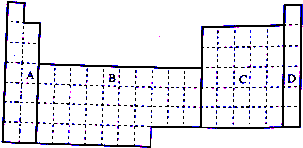
11.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:

(1)地壳中含量居于第二位的元素在周期表中的位置是第三周期第ⅣA族.
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式 .
.
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能作该反应催化剂的是(填序号)bc.
a.MnO2 b.HI c.Na2SO3 d.FeCl3
(4)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如图反应:

X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,M中阳离子的鉴定方法取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.

(1)地壳中含量居于第二位的元素在周期表中的位置是第三周期第ⅣA族.
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
 .
.(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能作该反应催化剂的是(填序号)bc.
a.MnO2 b.HI c.Na2SO3 d.FeCl3
(4)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | ||
| 2 |

X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,M中阳离子的鉴定方法取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
18.有A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍.由三种元素组成的化合物的化学式不可能是( )
| A. | A3BC4 | B. | A2(BC4)3 | C. | A2BC3 | D. | A2BC4 |
8.下列离子能大量共存的是( )
| A. | CH3COO-、H+、Na+、K+ | B. | NH4+、OH-、Ba2+、Cl- | ||
| C. | Ca2+、NO3-、Ba2+、K+ | D. | NO3-、Ba2+、H+、Fe2+ |
15.下列反应中,属于加成反应的是( )
| A. | 苯与溴水混合,振荡静置,溴水层褪色 | |
| B. | 乙烯通入酸性髙锰酸钾溶液中,溶液褪色 | |
| C. | 乙烯通入溴的四氛化碳溶液中,溶液褪色 | |
| D. | 甲烷与氯气混合光照,气体颜色变浅 |
 ;
;