题目内容
10.FeCl3水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+.改变下列条件:①升高温度;②加少量浓盐酸;③加水稀释;④加少量铁粉;⑤加少量Na2CO3(s)
(1)使水解平衡右移的是①③④;
(2)使水解平衡左移的是②④;
(3)使溶液pH减小的是①②.
分析 Fe3+易水解,水解生成H+,方程式为:Fe3++3H2O?Fe(OH)3+3H+,依据水解方程式判断平衡移动的方向.
解答 解:Fe3+易水解,水解生成H+,水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,
①水解均为吸热反应,故温度升高,平衡右移,溶液的pH值减小;
②加少量浓盐酸,即加入H+,导致H+浓度增大,平衡左移,但是氢离子浓度增大,pH减小;
③加水稀释,溶液浓度变小,平衡右移,氢离子浓度减小,pH变大;
④加少量铁粉,发生反应Fe+2Fe3+=3Fe2+,故导致Fe3+浓度减小,平衡左移,pH值增大;
⑤加少量Na2CO3(s),碳酸根与氢离子反应导致氢离子浓度减小,平衡右移,溶液的pH值增大,
依据以上分析,故答案为:(1)①③④;(2)②④;(3)①②.
点评 本题考查盐类水解的原理及应用,题目难度不大,注意把握水解原理,学习中注重相关基础知识的积累.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
20.国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17%.下列说法不正确的是( )
| A. | CO2属于酸性氧化物 | |
| B. | CO2是导致酸雨发生的主要原因 | |
| C. | 可用Na2CO3溶液捕捉(吸收)CO2 | |
| D. | 使用氢能源替代化石燃料可减少CO2排放 |
1.下列离子方程式书写不正确的是( )
| A. | 常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
18.下列做法或实验操作正确的是( )
| A. | 振荡分液漏斗时应关闭其玻璃塞和活塞 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 在50mL量筒中配制0.1000mol•L-1碳酸钠溶液 | |
| D. | 检验NH4+时,向试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
5.在容积一定的密闭容器中,反应2A?B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
| A. | 正反应是吸热反应,且A不是气态 | B. | 正反应是放热反应,且A不是气态 | ||
| C. | 正反应是吸热反应,且A是气态 | D. | 正反应是放反应,且A是气态 |
5.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的工艺流程如下:
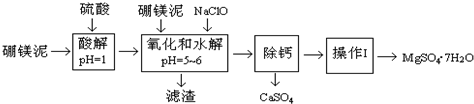
已知:NaClO与Mn2+反应产生MnO2沉淀.
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸来配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、100mL容量瓶.
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是A.
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤蒸发浓缩、趁热过滤.
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4•7H2O196.8g,则MgSO4•7H2O的产率为80.0%(相对分子质量:MgSO4•7H2O-246 MgO-40).

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸来配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、100mL容量瓶.
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是A.
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4•7H2O196.8g,则MgSO4•7H2O的产率为80.0%(相对分子质量:MgSO4•7H2O-246 MgO-40).
9.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1:

回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.副产品甲阳离子是Fe2+.
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol•L-1,当溶液的pH等于10时,Mg(OH)2开始沉淀.
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O═H2TiO3↓+2H+.
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式TiO2+4e-═Ti+2O2-.

回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.副产品甲阳离子是Fe2+.
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O═H2TiO3↓+2H+.
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式TiO2+4e-═Ti+2O2-.


 )的废水可以通过构成微生物电池除去,其原理如图所示.
)的废水可以通过构成微生物电池除去,其原理如图所示.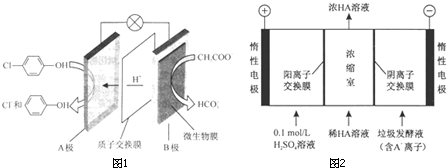
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.