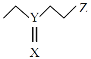题目内容
【题目】ZulemaBoqas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )

A.负极区是强碱性环境
B.每消耗2.24L(标况)的空气,有0.4mol电子
C.负极反应为:CH3COO-+2H2O-8e- =2CO2↑+7H+
D.Y为阴离子选择性交换膜
【答案】C
【解析】
A.由图可知,负极为有机废水CH3COO-的一极,CH3COO-失电子发生氧化反应,产生CO2气体逸出,使溶液酸性增强,故负极区溶液的酸性较强,A错误;
B.2.24 L标准状况下的空气的物质的量是1 mol,其中含有O2的物质的量是n(O2)=![]() ×0.1 mol=0.02 mol,1 molO2在反应中得到4 mol电子,则0.02 molO2反应,转移电子的物质的量为0.08 mol,B错误;
×0.1 mol=0.02 mol,1 molO2在反应中得到4 mol电子,则0.02 molO2反应,转移电子的物质的量为0.08 mol,B错误;
C.由图可知,负极为有机废水CH3COO-的一极,失电子发生氧化反应,电极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+,C正确;
D.该装置工作时为原电池,原电池内电路中:阳离子移向正极、阴离子移向负极,从而达到脱盐目的,所以Y为阳离子交换膜、X为阴离子交换膜,D错误;
故合理选项是C。

 阅读快车系列答案
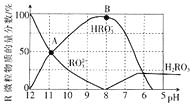
阅读快车系列答案【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1L恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJmol-1),请回答下列问题:
2SO3(g) ΔH=-196.6kJmol-1),请回答下列问题:
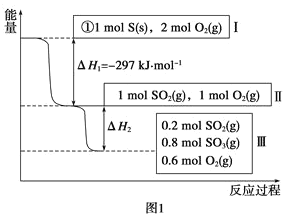
写出能表示硫的燃烧热的热化学方程式:___。
②ΔH2=___kJmol-1。
③在相同条件下,充入1molSO3和0.5mol的O2,则达到平衡时SO3的转化率为___;此时该反应___(填“放出”或“吸收”)___kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
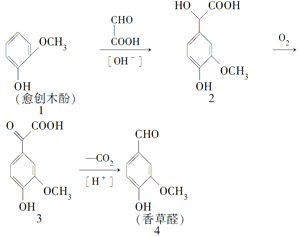
①CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3min到9min,v(H2)=___molL-1min-1。
CH3OH(g)+H2O(g) ΔH=-49.0kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3min到9min,v(H2)=___molL-1min-1。

②能说明上述反应达到平衡状态的是___(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
③为加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有___(填编号)。
A.升高温度 B.缩小容器体积 C.再充入水蒸气 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考下表中合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数。下列说法正确的是___。
CH3OH(g)的平衡常数。下列说法正确的是___。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高