题目内容
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:
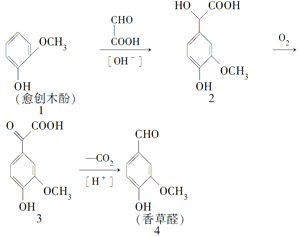
下列说法中正确的是( )
A. 反应1→2中原子利用率为90%
B. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
C. 化合物2在一定条件下可发生酯化反应
D. 等物质的量的四种化合物分别与足量NaOH溶液反应,消耗NaOH物质的量之比为1∶4∶3∶2
【答案】C
【解析】A、由1和2的结构简式可知,1→2为加成反应,苯环断裂C-H键,与醛基加成,因此原子利用率为100%,故A错误;B、在化合物3、4中都含有酚羟基,所以不能用氯化铁溶液进行检验制得的香草醛中是否混有化合物3,故B错误;C、化合物2中含有酚羟基、醇羟基,可以发生酯化反应,故C正确;D、酚羟基、羧基能与NaOH发生反应,1中有1个酚羟基,2中有1个酚羟基和1个羧基,3中有1酚羟基和1个羧基,4中有1个酚羟基,所以等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比1∶2∶2∶1,故D错误。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目