题目内容
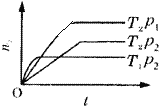
【题目】将不同物质的量的M(g)和N(g)分别通入体积为2L的恒容密闭容器中,进行反应M(g)+N(g)![]() P(g)+Q(g),得到如下两组数据:
P(g)+Q(g),得到如下两组数据:

下列说法正确的是( )
A.将实验2的体积压缩为1L,c(Q)为0.4molL-1
B.温度升高,该反应的平衡常数增大
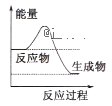
C.选择合适的催化剂可降低该反应的活化能,提高M的转化率
D.实验1中M的化学反应速率为0.32molL-1min-1
【答案】A
【解析】
A.由于该反应是反应前后气体体积不变的反应,改变压强,化学平衡不发生移动,所以将实验2的体积压缩为1 L,任何物质的浓度是原来的2倍,c(Q)为0.4 mol/L,A正确;
B.根据实验1:反应开始时,n(M)= 4mol,n(N)=2 mol,平衡时n(Q)=1.6 mol,则n(P)= n(Q)=1.6 mol,n(M)=2.4 mol,n(N)=2 mol-1.6 mol=0.4 mol,由于该反应是反应前后气体体积不变的反应,所以在650℃的平衡常数K1=![]() =2.67;在900℃时,反应达到平衡时,n(P)=n(Q)=0.4 mol,n(M)=1.6 mol,n(N)=1 mol-(2 mol-1.6 mol)=0.6 mol,K2=
=2.67;在900℃时,反应达到平衡时,n(P)=n(Q)=0.4 mol,n(M)=1.6 mol,n(N)=1 mol-(2 mol-1.6 mol)=0.6 mol,K2=![]() =0.17<2.67,说明升高温度,化学平衡逆向移动,B错误;
=0.17<2.67,说明升高温度,化学平衡逆向移动,B错误;
C.选择合适的催化剂可降低该反应的活化能,加快反应速率,但不能使化学平衡发生移动,因此不能提高M的转化率,C错误;
D.实验1中M物质改变的物质的量是△n(M)=4 mol-2.4 mol=1.6 mol,容器的容积是2 L,反应时间是5 min,所以用M表示的化学反应速率V(M)=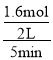 =0.16 molL-1min-1,D错误;
=0.16 molL-1min-1,D错误;
故合理选项是A。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】有下列三种有机物,实现它们之间相互转化所选试剂(均足量)正确的是( )
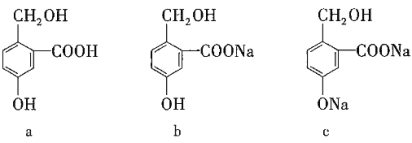
选项 | a转化为b | a转化为c | c转化为b |
A | NaOH | Na | CO2 |
B | Na2CO3 | NaOH | HCl |
C | NaHCO3 | NaOH | CO2 |
D | NaHCO3 | NaCl | HCl |
A.AB.BC.CD.D