题目内容
【题目】A、B、C、D、E、F是中学化学常见的六种单质,原子序数依次增大的短周期主族元素,其中D、E是固体,其余均为气体.图中其他物质均为化合物,六种元素都不在同一主族.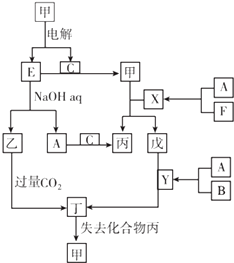
(1)写出下列物质的名称:甲 , 乙 .
(2)写出实验室制取F的化学方程式 , 检验F收集满的方法 .
(3)Y和CuO的反应方程式 .
(4)写出乙和过量CO2反应的离子方程式 .
(5)D和E形成原电池的两个电极,NaOH溶液是电解质溶液.E的一极为原电池的极,该极的电极反应式为 .
(6)73g X与足量的NaOH溶液反应放热Q kJ,写出该反应的热化学方程式 .
(7)D的最高价氧化物对应水化物的Ksp=1.8×10﹣11 , 该物质的溶液中,要使D离子的浓度降至1.8×10﹣9 mol/L,25℃时溶液的pH应调至 .
【答案】
(1)氧化铝;偏铝酸钠
(2)MnO2+4HCl(浓) ![]() ?MnCl2+2H2O+Cl2↑;将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满
?MnCl2+2H2O+Cl2↑;将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满
(3)2NH3+3CuO ![]() ?3Cu+N2+3H2O
?3Cu+N2+3H2O
(4)AlO ![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO ![]()
(5)负;Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O
(6)HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣0.5Q kJ/mol
(7)13
【解析】解:A、B、C、D、E、F是中学化学常见的六种单质,原子序数依次增大的短周期主族元素,六种元素都不在同一主族.电解甲到得到单质E与气体单质C,E能与氢氧化钠溶液反应生成乙与气体单质A,则E为Al、乙为NaAlO2、A为H2、甲为Al2O3、C为O2 , 由转化关系可知,丁为Al(OH)3 , 丙为H2O,F的原子序数大于Al,则F为Cl2 , B的原子序数小于氧元素,且单质为气体,故B为N2 , D与H、Cl不在同一主族,原子序数小于Al,大于氧,故D为Mg,则X为HCl、Y为NH3、戊为AlCl3 . (1)由上述分析可知.甲为氧化铝,乙为偏铝酸钠,所以答案是:氧化铝;偏铝酸钠;(2)实验室制取F(氯气)的化学方程式:MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑,检验氯气收集满的方法:将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满, 所以答案是:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,检验氯气收集满的方法:将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满, 所以答案是:MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑;将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满;(3)氨气和CuO的反应方程式:2NH3+3CuO
MnCl2+2H2O+Cl2↑;将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满;(3)氨气和CuO的反应方程式:2NH3+3CuO ![]() 3Cu+N2+3H2O,
3Cu+N2+3H2O,
所以答案是:2NH3+3CuO ![]() 3Cu+N2+3H2O;(4)偏铝酸钠和过量CO2反应的离子方程式:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO
3Cu+N2+3H2O;(4)偏铝酸钠和过量CO2反应的离子方程式:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO ![]() ,
,
所以答案是:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO ![]() ;(5)Mg和Al形成原电池的两个电极,NaOH溶液是电解质溶液,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al为负极,Mg为正极,负极电极反应式为:Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O,
;(5)Mg和Al形成原电池的两个电极,NaOH溶液是电解质溶液,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al为负极,Mg为正极,负极电极反应式为:Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O,
所以答案是:负极;Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O;(6)73 g HCl物质的量为2mol,与足量的NaOH溶液反应放热Q kJ,1molHCl反应放出热量为0.5Q kJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣0.5Q kJ/mol,
所以答案是:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣0.5Q kJ/mol;(7)D的最高价氧化物对应水化物Mg(OH)2的Ksp=1.8×10﹣11 , 该物质的溶液中,要使Mg2+离子 的浓度降至1.8×10﹣9 mol/L,则c(OH﹣)= ![]() mol/L=0.1mol/L,溶液中c(H+)=10﹣13mol/L=0.1mol/L,则溶液pH=﹣lg10﹣13=13,
mol/L=0.1mol/L,溶液中c(H+)=10﹣13mol/L=0.1mol/L,则溶液pH=﹣lg10﹣13=13,
所以答案是:13.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案