题目内容
关于溶液的下列说法正确的是
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
C.往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中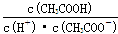 增大 增大 |
| D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① |
D
解析试题分析:A、c(H+):c(OH-)=1:10-2的溶液,说明c(H+)>c(OH-),所以该溶液显酸性,因此ClO-、CO32-一定不能大量存在,A不正确;B、水电离出来的c(H+)=10-13mol/L的溶液,说明该溶液中水的电离平衡是被抑制的,因此溶液可能显碱性,也可能显酸性。如果显碱性K+、Cl-、NO3-、I-一定能大量存在;如果显酸性,在酸性条件下NO3-能氧化I-,所以不能大量共存,B不正确;C、温度不变,则醋酸的电离常数不变,由于K=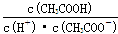 ,因此
,因此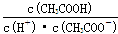 不变,C不正确;D、碳酸是二元弱酸,溶液中c(CO32-)最小。碳酸钠水解,CO32-溶液显碱性。碳酸氢纳溶液中HCO3-的浓度大,抑制HCO3-的电离,因此碳酸氢纳溶液中(CO32-)小,氮大于碳酸溶液中(CO32-)。(NH4)2CO3溶液中NH4+水解显酸性,促进CO32-的水解,所以溶液中c(CO32-)的大小关系为②>④>③>①,答案选D。
不变,C不正确;D、碳酸是二元弱酸,溶液中c(CO32-)最小。碳酸钠水解,CO32-溶液显碱性。碳酸氢纳溶液中HCO3-的浓度大,抑制HCO3-的电离,因此碳酸氢纳溶液中(CO32-)小,氮大于碳酸溶液中(CO32-)。(NH4)2CO3溶液中NH4+水解显酸性,促进CO32-的水解,所以溶液中c(CO32-)的大小关系为②>④>③>①,答案选D。
考点:考查离子共存、外界条件对电离平衡的影响、溶液中离子浓度大小比较等

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
下列对于25℃时pH为12的氨水,叙述正确的是
| A.由水电离的c(OH—)=1.0×10-2mol·L-1 |
B. |
C.与等体积、pH=2的盐酸混合后所得的溶液中: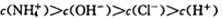 |
D.加入一定量pH=2的醋酸溶液混合后所得的溶液中: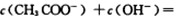 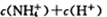 |
下列说法正确的是
| A.中和等体积、等物质的量浓度盐酸和醋酸溶液,盐酸所需NaOH溶液多于醋酸 |
| B.常温下,20 LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
C.向0.1 mol/LCH3COOH溶液中加入少量CH3COONa固 体,溶液中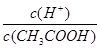 增大 增大 |
| D.一定温度下,10mL 0.50mol·L—1 NH4Cl溶液与20mL 0.25mol·L—1 NH4C1溶液含NH4+物质的量相同 |
已知:H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8;H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11。现将标准状况下2.24L的CO2和2.24L的SO2分别通入两份150mL1mol/LNaOH溶液中,关于两溶液的比较下列说法正确的是
| A.c(HCO3-)<c(CO32-) |
| B.两溶液都能使酸性高锰酸钾溶液褪色 |
| C.c(HCO3-)>c(HSO3-) |
| D.c(CO32-)+ c(HCO3-)=c(SO32-)+ c(HSO3-) |
下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
| A.1L0.1mol·L-1(NH4)2Fe(SO4)2溶液: c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| B.25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中: c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| C.25℃时,BaCO3饱和溶液(Ksp =8.1×10-9): c(Ba2+)= c(CO32-)>c(H+) = c(OH-) |
| D.1.0 mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
下列方程式中,属于水解反应的是
A.NH3 +H2O  NH3.H2O NH3.H2O |
B.HCO3— + H2O  H2CO3 + OH— H2CO3 + OH— |
C.H2O +H2O  H3O++OH— H3O++OH— |
D.HCO3— +H2O H3O+ +CO32— H3O+ +CO32— |