题目内容
9.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )| A. | 四种元素位于同一周期 | B. | b+1=d-1 | ||
| C. | 氢化物稳定性:H2Y>HZ | D. | 离子的氧化性:W3+>X+ |
分析 1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,即它们核外电子数相等,所以a-3=b-1=c+2=d+1,阳离子位于阴离子下一周期,在1-18号元素中只有金属Al能形成和上一周期阴离子具有电子层结构,所以W是Al元素,则X、Y、Z分别是Na、O、F元素,
A.四种元素位于不同周期;
B.阳离子核外电子数=质子数-电荷数,阴离子核外电子数=质子数+电荷数;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.元素的金属性越强,其阳离子氧化性越弱.
解答 解:1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,即它们核外电子数相等,所以a-3=b-1=c+2=d+1,阳离子位于阴离子下一周期,在1-18号元素中只有金属Al能形成和上一周期阴离子具有电子层结构,所以W是Al元素,则X、Y、Z分别是Na、O、F元素,
A.W和X位于第三周期、Y和Z位于第二周期,所以这四种元素位于不同周期,故A错误;
B.阳离子核外电子数=质子数-电荷数,阴离子核外电子数=质子数+电荷数,所以存在b-1=d+1,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性Z>Y,所以氢化物稳定性:H2Y<HZ,故C错误;
D.元素的金属性越强,其阳离子氧化性越弱,金属性X>W,所以离子的氧化性:W3+>X+,故D正确;
故选D.
点评 本题考查原子结构和元素性质,正确判断元素是解本题关键,知道阴阳离子核外电子数计算方法,易错选项是D.

练习册系列答案
相关题目
6.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域.一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如图1:
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表一所示;
②不同离子沉淀的pH如图2所示.
(1)步骤I中进行原料预处理的目的为除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量.
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤V中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.
(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;K甲[Y2(C2O4)3]=8.0×10-28
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
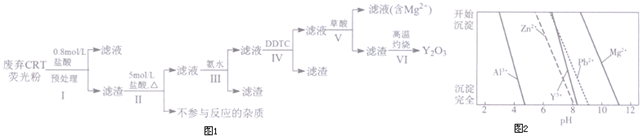
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表一所示;
②不同离子沉淀的pH如图2所示.
| 成分 含量/% 阶段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤V中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.
(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;K甲[Y2(C2O4)3]=8.0×10-28
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.

20.温度一定时,用水稀释0.1mol•L-1氨水时,随着水量的增加而减小的是( )
| A. | $\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | ||
| C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
4.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等,下列判断不正确的是( )
| R | |||
| T | Q | W |
| A. | 原子半径:T>Q>R | |
| B. | 最简单气态氢化物的还原性:R>Q | |
| C. | 含T的盐溶液一定显酸性 | |
| D. | 最高价氧化物对应水化物的酸性:Q<W |
14.下列关于原子结构、元素性质的说法正确的是( )
| A. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| B. | 同种元素的原子均有相同的质子数和中子数 | |
| C. | 非金属元素组成的化合物中只含共价键 | |
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
1.在下列能级中,所含的原子轨道数最大的是( )
| A. | 3d | B. | 5f | C. | 6p | D. | 7s |
18.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使高锰酸钾酸性溶液褪色,甲烷和苯不能使高锰酸钾酸性溶液褪色 | |
| D. | 苯与硝酸在50~60°C发生取代反应,甲苯与硝酸在30°C就能发生取代反应 |
19.钾元素的核素${\;}_{19}^{39}$K中,中子数与质子数之差为( )
| A. | 1 | B. | 19 | C. | 20 | D. | 39 |
