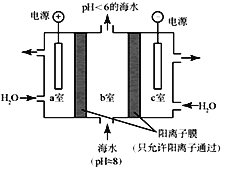
题目内容
【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程图如下:

资料:碳酸锂在水中溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是_______。
(2)过程ii加入足量NaOH溶液的作用是______。
(3)过程iii采用不同氧化剂分别进行实验,均采用Li含量为3.7%的原料,控制pH为3.5,浸取1.5h后,实验结果如下表所示:
序号 | 酸 | 氧化剂 | 浸出液Li+浓度(g/L) | 滤渣中Li含量/% |
实验1 | HCl | H2O2 | 9.02 | 0.10 |
实验2 | HCl | NaClO3 | 9.05 | 0.08 |
实验3 | HCl | O2 | 7.05 | 0.93 |
①实验2中,NaClO3与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为______。
②结合实验结果和①中的现象,最终选择H2O2作为氧化剂,原因是______。
③过程iii得到的浸出液循环两次的目的是_____。
(4)浸出液中存在大量H2PO4和HPO42,已知:H2PO4 HPO42 +H+,HPO42 PO43+H+,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因_____。
(5)对比过程iv和v,说明过程iv不用饱和Na2CO3溶液的原因______。
(6)简述过程vi的操作_______。
【答案】增大接触面积,加快反应速率 溶解Al,使其分离出去 ClO3+5Cl+6H+ =3Cl2↑+3H2O Li+的浸出率较高,且较环保(节约酸和氧化剂的用量) 提高浸出液中Li+ 浓度(或提高氧化剂和酸的利用率/节约后续纯碱的用量) CO32结合H+,c(H+)减小,H2PO4![]() HPO42 +H+,HPO42
HPO42 +H+,HPO42![]() PO43+H+,两个电离平衡均向右移动,c(PO43)增大,与Fe3+结合形成磷酸铁晶体 过程iv若使用饱和Na2CO3溶液,其中c(CO32)较大,易形成Li2CO3沉淀与磷酸铁沉淀一同析出,减少高纯Li2CO3的产量 用热水洗涤,干燥
PO43+H+,两个电离平衡均向右移动,c(PO43)增大,与Fe3+结合形成磷酸铁晶体 过程iv若使用饱和Na2CO3溶液,其中c(CO32)较大,易形成Li2CO3沉淀与磷酸铁沉淀一同析出,减少高纯Li2CO3的产量 用热水洗涤,干燥
【解析】
(1)根据影响反应速率的因素分析过程i研磨粉碎的目的;
(2)根据铝可溶于氢氧化钠溶液分析;
(3)①实验2中,NaClO3与盐酸发生归中反应反应生成氯气、氯化钠、水;
②实验1与实验3比,浸出液中Li+浓度高;
③浸出液循环利用,可以提高氧化剂和酸的利用率;
(4)过程iv加入30%的Na2CO3溶液可以提高PO43的浓度;
(5)c(CO32)越大越易生成Li2CO3沉淀;
(6)根据温度越高碳酸锂溶解度越小分析;
(1)过程i研磨粉碎的目的是增大接触面积,加快反应速率;
(2)单质铝可溶于氢氧化钠溶液生成偏铝酸钠,所以过程ii加入足量NaOH溶液的作用是溶解Al,使其分离出去;
(3)①实验2中,NaClO3与盐酸发生归中反应生成氯气、氯化钠、水,反应离子方程式是ClO3+5Cl+6H+=3Cl2↑+3H2O;
②实验2生成氯气污染空气,增加了酸和氧化剂的用量,实验1与实验3比,Li+的浸出率较高,所以最终选择H2O2作为氧化剂;
③过程iii得到的浸出液循环两次的目的是提高氧化剂和酸的利用率,提高浸出液中Li+浓度;
(4)过程iv加入30%的Na2CO3溶液,CO32结合H+,c(H+)减小,H2PO4![]() HPO42+H+,HPO42
HPO42+H+,HPO42![]() PO43+H+,两个电离平衡均向右移动,c(PO43)增大,与Fe3+结合形成磷酸铁晶体;
PO43+H+,两个电离平衡均向右移动,c(PO43)增大,与Fe3+结合形成磷酸铁晶体;
(5)过程iv若使用饱和Na2CO3溶液,其中c(CO32-)较大,易形成Li2CO3沉淀与磷酸铁沉淀一同析出,减少高纯Li2CO3的产量,所以过程iv不用饱和Na2CO3溶液;
(6)温度越高碳酸锂溶解度越小,过程vi的操作是用热水洗涤,干燥。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】含氮化合物与生产、生活、生命和环境息息相关。
(1)NO加速臭氧层被破坏,其反应过程如图所示。
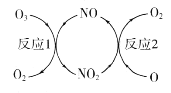
①NO的作用是________________________。
②已知:O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
反应l:O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
则反应2的热化学方程式为____________________________。
(2)肌红蛋白(Mb)是肌肉内储存氧的蛋白质,构成肌红蛋白的甘氨酸(H2NCH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下 三种离子的物质的量分数(δ)与[
三种离子的物质的量分数(δ)与[![]() ]的关系如图所示。
]的关系如图所示。

①溶液呈中性时,三种离子浓度由大到小的顺序为______________________。
②向AG=12的溶液中加入过量NaOH溶液时,主要反应的离子方程式为______________。
(3)肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
①计算37℃时,上述反应的平衡常数K=__________kPa-1(气体和溶液中的溶质分别用分压和物质的量浓度表示)。
②37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
③温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
④研究发现,v正=k正·c(Mb)·p(O