题目内容
5.现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复).| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-.(写出有关离子方程式)
(2)若25℃时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度106倍.
(3)将0.1mol•L-1的C溶液逐滴加入等体积、0.2mol•L-1的A溶液中,反应后溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+).
分析 由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+;在所有的阳离子和阴离子组成的物质中,只有硫酸铝和氢氧化钡反应沉淀量先增加后减少但不消失,所以E是硫酸铝,B是氢氧化钡;
在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、碳酸钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,A为碳酸钠、C是盐酸;
综上所述,A、B、C、D、E分别为碳酸钠、氢氧化钡、盐酸、硝酸银、硫酸铝;
(1)碳酸钠能够发生水解生成碳酸氢根离子和氢氧根离子,溶液呈碱性;
(2)根据盐酸抑制水的电离以及硫酸铝促进水的电离,利用水的离子积常数计算出水电离出的氢离子浓度来比较;
(3)反应后溶质为等浓度的碳酸钠、碳酸氢钠和氯化钠,碳酸根离子的水解程度大于碳酸氢根离子,溶液呈碱性,据此判断溶液中离子浓度大小.
解答 解:由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,在所有的阳离子和阴离子组成的物质中,只有硫酸铝和氢氧化钡反应沉淀量先增加后减少但不消失,所以E是硫酸铝,B是氢氧化钡;
在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、碳酸钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,A为碳酸钠、C是盐酸;
综上所述,A、B、C、D、E分别为:碳酸钠、氢氧化钡、盐酸、硝酸银、硫酸铝;
(1)A为碳酸钠,碳酸根水解产生氢氧根使溶液呈碱性,水解的离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)盐酸溶液的pH=4,则C(H+)=10-4mol/L,则C(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10mol/L,OH-完全是由水电离产生,所以水电离出的氢离子浓度=10-10mol/L;硫酸铝在溶液中水水解使水显示酸性,溶液中的氢离子浓度就是水电离出的氢离子浓度,PH=4,则C(H+)=10-4mol/L,所以硫酸铝溶液中水电离出的氢离子浓度是盐酸溶液中水电离出的氢离子浓度的106倍,
故答案为:106;
(4)将0.1mol•L-1的盐酸溶液逐滴加入等体积、0.2mol•L-1的碳酸钠溶液中,反应后溶质为等浓度的碳酸氢钠、碳酸钠和氯化钠,碳酸根离子的水解程度大于碳酸氢根离子,溶液呈碱性,则c(HCO3-)>c(CO32-)、c(OH-)>c(H+),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查常见离子的检验,题目难度中等,涉及知识点较多、综合性较强,根据离子的共存、离子的性质来推断物质是解答本题的关键,注意掌握判断离子浓度大小常用方法.

| A. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次降低 | |
| B. | 制备纯净的氯乙烷可用等物质的量乙烷和氯气在光照条件下反应 | |
| C. | 等物质的量的乙烷、乙烯和苯分别在氧气中充分燃烧,消耗氧气最多的是苯 | |
| D. | 用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,18O存在于水、乙醇以及乙酸乙酯 |
| A. | 该电池工作时,正极反应为:2AgCl+2e-═2Cl-+2Ag | |
| B. | 镁电极作该电池负极,负极反应为:Mg-2e-═Mg2+ | |
| C. | 当有24g Mg被氧化时,有108 g AgCl被还原 | |
| D. | 装备该电池的鱼雷在水中行进时,海水作为电解质溶液 |
| A. | 苯与液溴制溴苯的反应: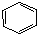 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$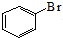 +HBr +HBr | |
| B. | 乙酸与乙醇的酯化反应:CH3COOH+CH3CH2${\;}_{\;}^{18}$OH$→_{△}^{浓H_{2}SO_{4}}$CH3CO${\;}_{\;}^{18}$OCH2CH3+H2O | |
| C. | 溴乙烷与NaOH水溶液混和共热 CH3CH2Br+NaOH$→_{△}^{水}$CH2=CH2+H2O+NaBr | |
| D. | 乙醇的消去反应 CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
| A. | 0.1 ( b-2a ) mol/L | B. | 10 ( 2a-b ) mol/L | ||
| C. | 10 ( b-a ) mol/L | D. | 10 ( b-2a ) mol/L |
| A. | 标准状况下22.4 L的CCl4中含有NA个分子 | |
| B. | 1 mol Cl2溶于足量水中一定转移NA个电子 | |
| C. | 18 g 18O2和18O3中一共含有NA个18O原子 | |
| D. | 1 mol•L-1的NaOH溶液中共含有NA个Na+ |
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| A. | 系列①的(a)物质中没有离子键,应有共价键和分子间作用力 | |
| B. | 系列③中(c)物质的沸点比HCl高是因为(c)中的共价键更牢固 | |
| C. | 系列②中(b)物质的元素的原子序数应为35,且该物质常温下为液态 | |
| D. | 系列④中H2O沸点变化出现反常,是因为分子内有氢键的影响 |
| A. | 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 | |
| B. | 除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 | |
| C. | 做过银镜反应的试管:加入稀硝酸洗涤 | |
| D. | 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离 |